縮合剤
縮合剤(しゅくごうざい、condensation agent)または 脱水縮合剤(だっすいしゅくごうざい、dehydration-condensation agent)とは付加脱離反応により、エステル・アミドなどのカルボン酸誘導体をワンポット合成するための反応試剤である。特にペプチド合成には温和な条件下で付加脱離反応を進行させる必要があり、その合成法開発の過程で多様な縮合剤が開発された。カップリング剤の範疇に含まれる。
縮合剤には、カルボン酸無水物、酸アジド、活性エステルなど反応系中で活性カルボン酸誘導体を生成するものがほとんどであるが、向山試薬のように酸化還元反応により形式的に水を除去するものも存在する。光延試薬などもこの一種である。
古典的縮合反応
[編集]反応機構的には、カルボン酸の脱水縮合反応は可逆反応であるため、反応の生成物である水を反応系より除去するか、遊離カルボン酸を脱離活性の高い脱離基を持つ酸塩化物・酸無水物などに変換してから反応させることで化学平衡を生成系側に移動させることで収率良くカルボン酸誘導体を得ることが出来る。古典的反応を挙げると前者の代表例がフィッシャーのエステル合成であり、後者の代表例がショッテン・バウマン反応である。
これらの反応は簡単な基質の場合今でも用いられるが、強熱や強酸成分といった条件を必要とし、これらの条件下ではラセミ化を惹起するペプチド合成には適用しがたい反応であった。
またフラグメント合成法(ある程度の長さを持つペプチド鎖同士を縮合させる方法。ラセミ化を起こしやすい)などでは脱保護された反応原料を速やかに縮合させる必要があり、活性種を単離することなく中性かつ温和な条件下で定量的に付加脱離反応を進行させる反応試剤が求められた。
アミド縮合剤の開発
[編集]カルボジイミド
[編集]1950年代、アミドの脱水縮合剤として最初に登場したのはN,N'-ジシクロヘキシルカルボジイミド(DCC)であった。これはカルボン酸を系内で対称酸無水物に導き、ワンポットでアミド結合が形成できる点で画期的なものであった。DCCはペプチド合成に用いられて大きな成果を挙げたが、ラセミ化の問題は残った。
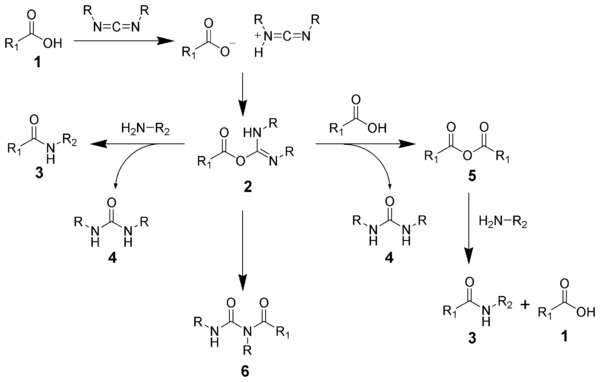
しかし後にHOBtが導入され、このものの活性エステルを経由することでラセミ化がかなり抑制されることが報告された。
DCCはかぶれ・アレルギー誘発などの欠点があり、また副生成物としてできるジシクロヘキシル尿素の溶解性が低く、除去しにくい。これを改良したWSCD(水溶性カルボジイミド)が登場し、WSCD-HOBt法はアミド結合生成の標準的手段として普及した。
-
HOBtの構造式
-
DCCの構造式
-
WSCDの構造式
DPPA
[編集]
これと別系列の縮合剤として、塩入孝之らはジフェニルリン酸アジド(DPPA)を開発した。カルボン酸を酸アジドへ導き、アミンと反応させるもので、活性化が穏和なためラセミ化が少ないという利点を有する。
BOP試薬
[編集]またカストロらは、リン酸アミドとHOBtを結合させたような構造のBOP試薬を開発した。これはカルボン酸と直接に活性エステルを形成し、アミド結合を作る高性能な試薬である。が、副生成物のHMPAが発ガン性の強い化合物であるためこの欠点を改良したPyBop、TBTUなどの試薬が登場している。
-
BOP Castro試薬
-
PyBoP®
DMT-MM
[編集]2-クロロ-4,6-ジメトキシトリアジン (CDMT) に基づく脱水縮合剤が国嶋崇隆らにより開発されている。1997年には、N-メチルモルホリン (NMM) に付加させた (DMT-MM) を開発した。これは水やアルコール中でもアミド化を行うことができる。
エステル化の縮合剤
[編集]一般にアルコール酸素の求核性はアミン窒素のそれより低いため、カルボン酸側をより強く活性化する必要がある。縮合剤を用いる場合、混合酸無水物法を用いる手法が多く行われる。山口ラクトン化反応などに用いられる、2,4,6-トリクロロベンゾイルクロリドが代表的で、椎名勇らによって開発された2-メチル-6-ニトロ安息香酸無水物(MNBA)を用いる方法も報告されている。
カルボジイミドはエステル結合生成にも有用である。この場合、触媒量の 4-ジメチルアミノピリジン (DMAP) を加えておくことで反応性が向上する。
また、触媒として作用するジメシチルアンモニウムペンタフルオロベンゼンスルホナートなどもある。





