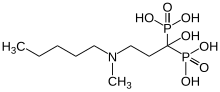
イバンドロン酸
表示
(イバンドロネートから転送)
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | ボンビバ |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 0.6% |
| 血漿タンパク結合 | 90.9 to 99.5% (concentration-dependent) |
| 代謝 | 無し |
| 半減期 | 10 - 60 時間 |
| 排泄 | 腎排泄 |
| 識別 | |
| CAS番号 |
114084-78-5 |
| ATCコード | M05BA06 (WHO) |
| PubChem | CID: 60852 |
| DrugBank |
DB00710 |
| ChemSpider |
54839 |
| UNII |
UMD7G2653W |
| KEGG |
D08056 |
| ChEMBL |
CHEMBL997 |
| 化学的データ | |
| 化学式 | C9H23NO7P2 |
| 分子量 | 319.229 g/mol |
| |

イバンドロン酸(イバンドロンさん、英: ibandronic acid)、またはイバンドロネート(英: ibandronate)は、ビスフォスフォネート薬群のひとつ。日本での製品名はボンビバで静脈注射剤と錠剤がある[注釈 1][1][2]。2022年11月に大正製薬が日本での製造販売を担うことになった[3]。
薬理
[編集]他のビスフォスフォネート薬と同様に、骨に対して高い親和性を持ち、骨表面に吸着し、破骨細胞の機能障害およびアポトーシスを誘導することで破骨細胞を減少させ、骨吸収を抑制する。
- 経口ビスフォスフォネート剤は、その約99 %が糞便中に排泄され、約1%しか体内に吸収されないとされるが、経静脈的投与では投与された薬剤のほぼ100 %が利用される。経静脈投与のビスフォスフォネート製剤としては、イバンドロネートの他にアレンドロン酸ナトリウム (月に1回投与) とゾレドロン酸水和物 (1年に1回投与) も販売されている。
適応
[編集]禁忌
[編集]注射剤、錠剤共に、低カルシウム血症の患者で禁忌であるほか、錠剤では、食道狭窄またはアカラシア(食道弛緩不能症)等の患者と服用時に立位または坐位を60分以上保てない患者を禁忌としており、服用時に充分な水と共に服用し上部消化管障害を予防する様に求められている。
副作用
[編集]日本国内で実施された治験では、注射剤で24.4 %、錠剤で27.7 %に副作用が見られた。主な副作用は、下痢(注:0.4 %、錠:4.5 %)、背部痛(2.6 %、4.2 %)、頭痛(1.8 %、2.9 %)、筋肉痛(2.1 %、1.3 %)、関節痛(2.0 %、2.9 %)、疲労・倦怠感(1.7 %、2.9 %)であった[4][5]。
重大な副作用は、
- 上部消化管障害(錠剤のみ:食道穿孔、食道狭窄、食道潰瘍、胃潰瘍(0.3 %)、十二指腸潰瘍、食道炎(0.3 %)、食道びらん等)、
- 顎骨壊死・顎骨骨髄炎、外耳道骨壊死、大腿骨転子下および近位大腿骨骨幹部の非定型骨折、(低カルシウム血症 類薬で)
である。閉経後骨粗鬆症に対する経静脈投与のビスフォスフォネート剤は、総じて安全との報告がある[6]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ “ボンビバ静注1mgシリンジ 添付文書” (2016年5月). 2016年6月30日閲覧。
- ^ “ボンビバ錠100mg 添付文書” (2016年5月). 2016年7月4日閲覧。
- ^ https://www.chugai-pharm.co.jp/news/detail/20221124150000_1260.html
- ^ “ボンビバ静注1mgシリンジ インタビューフォーム” (PDF) (2016年5月). 2016年6月30日閲覧。
- ^ “ボンビバ錠100mg インタビューフォーム” (PDF) (2016年5月). 2016年6月30日閲覧。
- ^ Sieber P, Lardelli P, Kraenzlin CA, Kraenzlin ME, Meier C (2013). “Intravenous bisphosphonates for postmenopausal osteoporosis: safety profiles of zoledronic acid and ibandronate in clinical practice.”. Clin Drug Investig 33 (2): 117-22. doi:10.1007/s40261-012-0041-1. PMID 23184667.
