ブルック転位
ブルック転位(ブルックてんい、英語: Brook rearrangement)は、有機化学における転位反応のひとつで、ヒドロキシ基を持つ有機ケイ素化合物に塩基を作用させ、シリル基を炭素上から酸素上に移してシリルエーテルを得る反応である。名称はカナダの化学者、エイドリアン・G・ブルックに因む[1][2]。
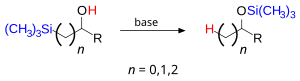
シリル基 (R'3Si-) 上の置換基 (R') は脂肪族、芳香族のいずれも可であり、アルコール部位は脂肪族または芳香族の基を持つ二級、三級のものが基質となる。アミン、水酸化ナトリウム、有機リチウム化合物、アルカリ金属の合金(Na/Kなど)が塩基として用いられる。α-ヒドロキシ有機ケイ素化合物(上図、n = 0)を基質として起こる1,2-ブルック転位の例が多いが、より長い距離の転位 (1,3- (n = 1)、1,4-転位 (n = 2))も可能である。
反応機構[編集]
ブルック転位はまず、塩基によるヒドロキシ基からのプロトン引き抜きから始まる。現れるアルコキシド上の酸素は求核性が強く、ケイ素上を攻撃して炭素置換基と置き換わり、脱離したカルバニオンが最後にプロトン化を受けて生成物となる。1,2-転位では、図示されたような三員環を経由するとされている。同様の機構で四、五および六員環遷移状態を経る1,3、1,4および1,5-転位も起こるが、遷移状態の安定性が続く転位反応の反応性を低下させるため一般的には1,2-転位が最も有利である。

1-トリフェニルシリル-(1-フェニル)エタノールのブルック転位の場合、活性化エンタルピーは比較的小さい一方で活性化エントロピーが負に大きい値をとる。このことは環状の遷移状態の存在を支持している。芳香環のパラ位の電子求引基がカルバニオン中間体を安定化させる置換基効果がある。
熱力学的にはSi-O結合の形成がブルック転位の駆動力となっている。転位で失われるSi-C、O-Hの結合エネルギーの和は451(Si-C) + 427(O-H) = 878 kJ/mol、転位で得られるSi-O、C-Hの結合エネルギーの和は 809(Si-O) + 338(C-H) = 1147 kJ/mol と求められている。
1,2-ブルック転位は立体保持で進む。

メチル(2-ナフチル)(フェニル)シランの (+)-エナンチオマー 1 を 2 → 3 の立体反転を経て光学活性な α-ヒドロキシシラン 5 に誘導し、Na/K合金を作用させてブルック転位をさせたところ、還元後に得られたシランは 1 が立体反転した (-)-体 7 であった。このことから、5 → 6 の 1,2-ブルック転位が立体保持で進むことが確かめられた[3]。
関連する反応[編集]
アシルシラン (RC(=O)-SiR'3) に求核剤を付加させてアルコキシドを発生させる転位反応も知られる[4]。
シリルエーテルからシランに変換する「レトロブルック転位」の例も知られている[5]。
通常のBrook転位に比べ反応性は劣るものの、炭素原子上から窒素原子上へケイ素が転位するアザ-ブルック転位[6]や、炭素原子上から硫黄原子上に転位が進行するチア-ブルック転位も報告されている[7][8]。
参考文献[編集]
- ^ Brook, A. G. (1958). “Isomerism of Some α-Hydroxysilanes to Silyl Ethers”. J. Am. Chem. Soc. 80: 1886. doi:10.1021/ja01541a026.
- ^ Brook, A. G. (1974). “Molecular rearrangements of organosilicon compounds”. Acc. Chem. Res. 7 (3): 77-84. doi:10.1021/ar50075a003.
- ^ Brook, A. G.; Warner, C. M.; Limburg, W. W. (1967). “Stereochemistry of the silylcarbinol to silyl ether rearrangement”. Can. J. Chem. 45: 1231-1246. doi:10.1139/v67-203.
- ^ Patrocinio, A. F.; Moran, P. J. S. (2001). “Acylsilanes and their applications in organic chemistry”. J. Braz. Chem. Soc. 12: 7-31. doi:10.1590/S0103-50532001000100002.
- ^ Bailey, W. F.; Jiang, X. (2005). “Stereochemistry of the cyclization of alkoxy-substituted 5-hexenyllithiums: effect of solvent and lithium iodide on diastereoselectivity”. Tetrahedron 61 (13): 3183-3194. doi:10.1016/j.tet.2005.01.042.
- ^ Makoto Shimizu, Yuki Takao, Haruna Katsurayama and Isao Mizota (2013). “Synthesis of Indolin-3-ones and Tetrahydro-4-quinolones from α-Imino Esters”. Asian J. Org. Chem. 2: 130. doi:10.1002/ajoc.201200174/abstract.
- ^ A. G. Brook, J. M. Duff (1974). “Base-catalyzed rearrangement of aminomethylsilanes to methylaminosilanes”. J. Am. Chem. Soc. 96: 4692–4693. doi:10.1021/ja00821a065.
- ^ Kei Takeda, Sumi Koichi, Susumu Hagisawa (2000). “Reaction of silyl thioketones with lithium diethylphosphite: first observation of Thia–Brook rearrangement”. J. Organomet. Chem. 611: 449–454. doi:10.1016/S0022-328X(00)00482-4.

![{\displaystyle {\ce {RC(=O)-SiR'3\ + Nu^- ->\ [Nu(R)C(-O^-)-SiR'3] -> Nu(R)CH-OSiR'3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c5641e87113c9a318e5d47690f532a2b81a8892)