ヒト化抗体
ヒト化抗体(ひとかこうたい、英: humanized antibodies)は、ヒトで自然に産生される抗体との類似性を高めるためにタンパク質の配列が改変された、非ヒト種に由来する抗体である[1][2]。「ヒト化」のプロセスは、通常、ヒトに投与するために開発されたモノクローナル抗体(例えば、抗がん剤として開発された抗体)に適用される。特定の抗体を開発するプロセスが、ヒト以外の免疫系(例えば、マウスの免疫系)での生成を伴う場合に、ヒト化が必要となることがある。このようにして産生された抗体のタンパク質配列は、ヒトに自然に存在する相同抗体とは部分的に異なるため、ヒト患者に投与すると免疫原性となる可能性がある(ヒト抗マウス抗体も参照)。開発された抗体には他の種類もある。ヒト化抗体の国際一般名は、オマリズマブのように-zumabで終わる(モノクローナル抗体の命名法を参照)。
ヒト化抗体はキメラ抗体とは異なる。後者は、そのタンパク質配列がヒト抗体により類似する一方で、非ヒトタンパク質より大きな広がりを持っている。
組換えDNAのヒト化プロセスへの利用[編集]
ヒト化プロセスでは、組換えDNAを用いて哺乳類の細胞培養により発現できる構築物[3]を作成し、モノクローナル抗体の生産が可能であるという事実を利用している。すなわち、抗体を産生することができる遺伝子セグメントを単離し、バイオリアクターで増殖させることができる細胞にクローニングし、クローニングされた遺伝子のDNAから産生された抗体タンパク質を一括して採取ができる。組換えDNAを含むステップは、発現した抗体のタンパク質配列を変更するために容易に利用できる介入点を提供する。したがって、ヒト化プロセスで達成される抗体構造の変更はすべて、DNAレベルの技術によって実現される。ヒトの治療を目的とした抗体を誘導するためのすべての方法がヒト化ステップ(例:ファージディスプレイ)を必要とするわけではないが、本質的にはすべての方法が、抗体分子の一部の「挿入」または「交換」を可能にする技術に依存している。
「キメラ抗体」との区別[編集]
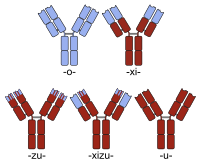
ヒト化は、通常、マウス-ヒト抗体キメラの作成とは異なると見なされる。したがって、抗体キメラの作成は、通常、よりヒトに近い抗体を得るために行われるが(マウス抗体の定常領域をヒトのものに置き換えることにより)、この種の単純なキメラは通常、ヒト化とは呼ばれない。むしろ、ヒト化抗体のタンパク質配列は、抗体がその標的抗原に結合する能力を決定する相補性決定領域(CDR)セグメントの一部が非ヒト由来であるにもかかわらず、ヒト変異体のタンパク質配列と本質的に同一である。
キメラ抗体名には、-xi-の語幹が含まれている。ヒト治療用に承認されたキメラ抗体の例として、アブシキシマブ(ReoPro)、バシリキシマブ(Simulect)、セツキシマブ(Erbitux)、インフリキシマブ(Remicade)、およびリツキシマブ(MabThera)が挙げられる。また、現在臨床試験中のキメラの例もいくつかある(例:バビツキシマブ、追加の例についてはソート可能なリストを参照)。
キメラ中間体を介したヒト化[編集]
しかしながら、ヒト化プロセスは、初期段階でのマウス-ヒトキメラ(マウスの可変領域をヒトの定常領域にスプライシングしたもの)の作成を含んでもよい。その後、キメラは、分子の可変領域にあるアミノ酸の配列を選択的に改変させることによって、さらにヒト化されてもよい。このプロセスは、抗体がもともと開発された特異性を保持するために「選択的」でなければならない。すなわち、可変領域のCDR部分は、抗体が目的の標的に結合する能力として不可欠であるため、これらの部分のアミノ酸を、開発の目的を損なうリスクなしに変更することはできない。CDR部分とは別に、可変領域のうちヒトと異なる部分は、適切な個々のアミノ酸を交換することで修正することができる。これは、突然変異誘発を用いてDNAレベルで達成される。
ヒト化キメラの命名には、両方の呼称の語幹(-xi-+-zu-)が含まれる。オテリキシズマブは、関節リウマチおよび糖尿病の治療のために現在臨床試験が行われているヒト化キメラの一例である[4]。
ヒト抗体「足場」への関連CDRの挿入によるヒト化[編集]
キメラ中間体を作成せずにヒト化抗体を作成することが可能である。ヒト化抗体の「直接」作成は、適切なCDRコーディングセグメント(所望の結合特性を担う、いわゆる「ドナー」)をヒト抗体「足場」(いわゆる「アクセプター」)に挿入することによって達成される。上述のように、これは、適切なベクター[3]と哺乳動物細胞での発現を用いた組換えDNA法によって達成される。すなわち、抗体がマウス(または他の非ヒト)において所望の特性を有するように開発された後、その抗体をコードするDNAを単離し、ベクターにクローニングし、配列を決定することができる。その後、抗体のCDRに対応するDNA配列を決定することができる。所望のCDRの正確な配列がわかれば、これらの配列をヒト抗体変異体のDNAを含む構築物に適切に挿入するための戦略を考案することができる[5][6]。この戦略はまた、CDR配列の読み取りに基づく線形DNA断片の合成を採用してもよい。
アレムツズマブは、ヒト化にキメラ中間体を含まない抗体の初期の例である。この場合、マウスシステムを用いてCD52に結合するために、「Campath-1」と名付けられたモノクローナルが開発された。その後、Campath-1の超可変ループ(CDRを含み、それによってCD52に結合する能力を付与する)を抽出し、ヒト抗体フレームワークに挿入された[1]。アレムツズマブは、B細胞性慢性リンパ性白血病の治療薬として承認されており[7]、現在、多発性硬化症を含む他のさまざまな疾患を対象とした臨床試験が行われている[8]。
マウスを用いないヒト治療用抗体の作成[編集]
ヒト治療のための抗体を発見する過程で、マウスまたは他の非ヒト哺乳動物の使用を完全に回避する技術がある。そのようなシステムの例としては、さまざまな「ディスプレイ法」(主にファージディスプレイ)や、ヒト免疫応答中に生じるB細胞レベルの上昇を利用する方法が挙げられる。
ディスプレイ法[編集]
これらのシステムは、特異的な抗体産生の選択的原理を採用し、微生物(例:ファージディスプレイ)あるいは無細胞抽出物(例:リボソームディスプレイ)を利用している。これらのシステムは、末梢血から単離されたヒトRNAから完全に誘導できる抗体遺伝子ライブラリの作成に依存している。これらのシステムの直接の生成物は抗体断片であり、通常は抗原結合フラグメント(Fab)または単鎖抗体(scFv)である。
これは、ディスプレイ法を用いて作成された抗体断片は、完全にヒト配列ではあるが、完全な抗体ではないことを意味する。したがって、完全な抗体内に導出された親和性を組み込んで発現させるために、本質的にはヒト化と同じプロセスが用いられている。
アダリムマブ(ヒュミラ)は、ファージディスプレイ法を用いて作成され、ヒト治療用に承認された例である[9][10]。
ヒト患者またはワクチン接種者からの抗体[編集]
モノクローナル抗体の発見では、ヒトの免疫反応を利用することが可能である。簡単に言えば、ヒトの免疫反応は、マウスや他の非ヒト哺乳類と同じように機能する。したがって、感染症、癌(がん)、ワクチン接種などの免疫系への攻撃を経験しているヒトは、その攻撃に向けたモノクローナル抗体の潜在的な供給源となる。このアプローチは、受動免疫の原理を利用した抗ウイルス療法の開発に特に適していると考えられている。このアプローチの変形は原理的に実証されており[11]、いくつかは商業的に開発されている[12]。
参照項目[編集]
脚注[編集]
- ^ a b “Reshaping human antibodies for therapy”. Nature 332 (6162): 323–7. (1988). doi:10.1038/332323a0. PMID 3127726.
- ^ “A humanized antibody that binds to the interleukin 2 receptor.”. Proc Natl Acad Sci U S A 86 (24): 10029–33. (Dec 1989). doi:10.1073/pnas.86.24.10029. PMC 298637. PMID 2513570. (This is an early example of the use of the term "humanized antibody".)
- ^ a b “Versatile vectors for transient and stable expression of recombinant antibody molecules in mammalian cells.”. J Immunol Methods 204 (1): 77–87. (May 1997). doi:10.1016/S0022-1759(97)00034-3. PMID 9202712.
- ^ Clinical Trials page list for otelixizumab
- ^ “SDR grafting—a new approach to antibody humanization.”. Methods 36 (1): 25–34. (May 2005). doi:10.1016/j.ymeth.2005.01.003. PMID 15848072.
- ^ “Humanization of an anti-CD34 monoclonal antibody by complementarity-determining region grafting based on computer-assisted molecular modeling.”. J Biochem 144 (1): 115–20. (July 2008). doi:10.1093/jb/mvn052. PMID 18424812.
- ^ DrugBank entry for alemtuzumab
- ^ Clinical Trials pages for alemtuzumab
- ^ Kempeni J. (Nov 1999). “Preliminary results of early clinical trials with the fully human anti-TNFalpha monoclonal antibody D2E7”. Ann Rheum Dis 58 (Suppl 1): I70–2. doi:10.1136/ard.58.2008.i70. PMC 1766582. PMID 10577977.
- ^ Rau R (Nov 2002). “Adalimumab (a fully human anti-tumour necrosis factor alpha monoclonal antibody) in the treatment of active rheumatoid arthritis: the initial results of five trials”. Ann Rheum Dis 61 (Suppl 2): 70–3. doi:10.1136/ard.61.suppl_2.ii70. PMC 1766697. PMID 12379628.
- ^ “Direct isolation of recombinant human antibodies against group B Neisseria meningitidis from scFv expression libraries”. J Immunol Methods 283 (1–2): 247–59. (Dec 2003). doi:10.1016/j.jim.2003.09.015. PMID 14659916.
- ^ http://www.theraclone-sciences.com/pdf/Theraclone_ISTAR.pdf Archived 2016-03-03 at the Wayback Machine. Example of method using human patients as source of monoclonal antibodies
