ジンクフィンガー
表示
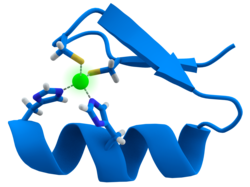

ジンクフィンガー(Zinc finger)はタンパク質ドメインの大きなスーパーファミリーの1つで、DNAに結合する性質を持つ。ジンクフィンガーは2つの逆平行βシートと1つのαヘリックスからなる。小さすぎて疎水中心を持たないため亜鉛イオンが安定化にとって重要である。
分類
最もよく研究されたC2H2クラスのジンクフィンガーでは、βシートの2つのシステイン残基とαヘリックスの2つのヒスチジン残基が亜鉛イオンとの結合に関わっていた。ジンクフィンガーの他の2つのクラスはC4とC6である。亜鉛イオンがDNAと結合して特別な構造モチーフを形成するため、ジンクフィンガーは遺伝子調節に重要な役割を果たす。
構造
それぞれのジンクフィンガーの構造はよく保存され、およそ30のアミノ酸残基からなり、ββαフォールドで亜鉛イオンを持つ。αヘリックスはC末端、βシートはN末端に位置する。
Cys-X2-4-Cys-X3-Phe-X5-Leu-X2-His-X3-Hisという保存配列を持つ。
タンパク質
Zif268などの多くの転写因子や調節タンパク質がジンクフィンガーを持つ。これらのタンパク質では通常、DNA二重らせんの主溝とジンクフィンガーのαヘリックスが相互作用する。
初期の神経の発達を調整する、ニューロン特異的な転写因子もジンクフィンガー構造を持つ。
結合
DNAと結合するαヘリックス中のアミノ酸残基は-1、3、6の位置にあり、αヘリックスが部分的に緩むことによりDNAと結合できるようになる。そのほかの位置のアミノ酸は、タンパク質が特定の塩基の位置に配置できるように支援したり、反対の鎖と4番目の結合を作ったりして結合特異性の維持に役立っている。
