「免疫」の版間の差分
ページ 免疫 を 免疫(旧版) へ移動: 一部に英語版翻訳内容が見られたが途中までであった。en:immune_system 05:07, 4 September 2008 完訳につき、移動。英語版に足らないこのページの� |
en:immune_system 05:07, 4 September 2008 (UTC) を翻訳 |
||
| 1行目: | 1行目: | ||
{{otheruseslist |
|||
#REDIRECT [[免疫(旧版)]] |
|||
|免疫系 |
|||
|免疫|免疫(医学)|免疫(旧版)|免疫(旧版)}} |
|||
{| {{immune_system line header}} |
|||
[[Image:Neutrophil with anthrax copy.jpg|thumb|right|250px|1個の[[好中球]](黄色)が[[炭疽菌]](オレンジ)を呑み込んでいる[[走査電子顕微鏡]]写真]] |
|||
免疫系(めんえきけい、[[:en:immune system|immune system]])は生体内で病原体やがん細胞を認識して殺滅することにより生体を病気から保護する多数の機構が集積した一大機構である。この機構はウイルスから寄生虫まで広い範囲の病原体を感知し、作用が正しく行われるために、生体自身の健常細胞や組織と区別しなければならない。この認識機構は、病原体は宿主にうまく感染できるように適応し新たな進化も遂げているので、複雑である。 |
|||
|} |
|||
この困難な課題を克服して生き延びるために、病原体を認識して中和する機構が一つならず進化した。細菌のような簡単な単細胞生物でもウイルス感染を防御する酵素系をもっている。その他の基本的な免疫機構は古代の真核生物において進化し現代の子孫である植物、魚類、ハ虫類、昆虫に残存している。これらの機構はディフェンシンと呼ばれる抗微生物ペプチドが関与する機構であり、貪食機構であり、<ref name=Beck> {{cite journal | last = Beck | first = Gregory | coauthors = Gail S. Habicht |title=Immunity and the Invertebrates | journal =Scientific American |pages=60--66 | date =November 1996 |url=http://www.scs.carleton.ca/~soma/biosec/readings/sharkimmu-sciam-Nov1996.pdf | format = [[PDF]] | accessdate = 2007-01-01}}</ref> [[補体系]]である。ヒトのような脊椎動物はもっと複雑な防御機構を進化させた。脊椎動物の免疫系は多数のタイプのタンパク質、細胞、器官、組織からなり、それらは互いに入り組んだダイナミックなネットワークで相互作用している。このようないっそう複雑な免疫応答の中で、ヒトの免疫系は特定の病原体に対してより効果的に認識できるよう長い間に適応してきた。この適応プロセスは適応免疫あるいは獲得免疫(あるいは後天性免疫)と呼ばれ、免疫記憶を作り出す。特定の病原体への初回応答から作られた免疫記憶は、同じ特定の病原体への2回目の遭遇に対し増強された応答をもたらす。獲得免疫のこのプロセスがワクチン接種の基礎である。 |
|||
免疫系が異常を起こすと病気になる場合がある。免疫系の活動性が正常より低いと、免疫不全病が起こり感染の繰り返しや生命を脅かす感染が起こされる。免疫不全病は、重症複合免疫不全症のような遺伝病に結果であったり、レトロウイルスによって起こされる後天性免疫不全症候群(AIDS)のような医薬品や感染が原因であったりする。反対に自己免疫病は、正常組織に対しあたかも外来生物に対するように攻撃を加える、免疫系の活性亢進からもたらされる。ありふれた自己免疫病として、関節リウマチ、Ⅰ型糖尿病、紅斑性狼瘡がある。免疫学は免疫系のあらゆる領域の研究をカバーし、ヒトの健康や病気に深く関係している。この分野での研究をさらに推し進めることは健康増進および病気の治療において重大な役割を果たすことが期待できる。 |
|||
== 重層的防御体制 == |
|||
免疫系は、感染から生体を、特異性を高めながら重層的な防御体制で守る。最も簡単なのは、物理的な障壁で、細菌やウイルスが生体に侵入するのを防ぐことである。病原体がこの障壁を破ったとき、即座に自然免疫(先天性免疫とも呼ばれる)が発動し非特異的な応答を行う。自然免疫はあらゆる植物および動物に認められる。<ref name=Litman>{{cite journal | author = Litman G, Cannon J, Dishaw L |title=Reconstructing immune phylogeny: new perspectives |journal=Nat Rev Immunol |volume=5 |issue=11 |pages=866--79 |year=2005 |pmid= 16261174 |doi=10.1038/nri1712}}</ref> しかし病原体が自然免疫もうまく逃れたなら脊椎動物は第3階層の防御反応を繰り出す。これが適応免疫であり、自然免疫によって発動される。ここで免疫系は感染を受ける間、応答を病原体への認識が改善されるよう適応する。この改善された応答は、次いで、病原体が排除された後も免疫記憶として残り、この病原体が侵入するたびにより早く強力な攻撃が加えられるようにする。<ref name=USC>{{cite web | last = Mayer | first = Gene |title=Immunology - Chapter One: Innate (non-specific) Immunity | work = Microbiology and Immunology On-Line Textbook | publisher = USC School of Medicine | date = 2006|url=http://pathmicro.med.sc.edu/ghaffar/innate.htm | accessdate = 2007-01-01}}</ref> |
|||
<div align="center"> |
|||
{| class="wikitable" |
|||
|+ '''免疫系の特徴''' |
|||
! style="background:#ccccff;" |項目 || style="background:#ccccff;" |[[#自然免疫|自然免疫系]]||style="background:#ccccff;" |[[#適応免疫|適応免疫系]] |
|||
|- |
|||
| style="background:#f1f1ff;" |応答の特異性|| なし || 病原体あるいは[[抗原]]特異的 |
|||
|- |
|||
| style="background:#f1f1ff;" |接触後最大応答までの時間 || 短い(即座) || 長い |
|||
|- |
|||
| style="background:#f1f1ff;" |関与する成分|| [[細胞性免疫|細胞性]]および[[液性免疫|体液性]] || [[細胞性免疫|細胞性]]および[[液性免疫|体液性]] |
|||
|- |
|||
| style="background:#f1f1ff;" |免疫記憶 || なし || あり |
|||
|- |
|||
| style="background:#f1f1ff;" |生物界での分布 || ほとんど全ての生物 ||[[顎口上綱|顎をもった脊椎動物]] |
|||
|} |
|||
</div> |
|||
自然免疫も適応免疫もその効果のほどは自己と非自己の分子の区別ができる能力をもった免疫系かどうかにかかっている。免疫学において自己分子とは、免疫系によって外来物質と区別できるような自己の身体要素のことである。<ref>Smith A.D. (Ed) ''Oxford dictionary of biochemistry and molecular biology.'' (1997) Oxford University Press. ISBN 0-19-854768-4</ref> 反対に非自己分子とは、免疫系によって外来物質と区別される外来分子のことである。非自己分子の一つのクラスは、[[抗原]](antigen; これは''anti''body ''gen''eratorの短縮語である)と呼ばれ、特異的な免疫受容体に結合し、免疫応答を誘発する物質と定義される。<ref name=Alberts/> |
|||
== 体表面障壁 == |
|||
生体を感染から守る障壁にはいくつかあって、機械的なもの、生化学的なもの、および生物学的なものがある。葉に見られるワックス性クチクラ、昆虫の外骨格、産み落とされた卵の殻や膜、そして皮膚。これらは機械的障壁の例であって、感染に対する防御ラインの第一線にある。<ref name=Alberts>{{cite book | last = Alberts| first = Bruce| coauthors = Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters |title=Molecular Biology of the Cell; Fourth Edition | publisher = Garland Science| date = 2002 | location = New York and London |url=http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=mboc4.TOC&depth=2 | id = ISBN 0-8153-3218-1}}</ref> しかし生体は外界に対して完全に密閉されることはできないのだから、肺、腸、性尿器路など、外界に対して開口された部分を守るのには他の系を作動させる。肺では咳やくしゃみは病原体や呼吸管の他の刺激物質を機械的に排除する。涙や尿を流す行動も病原体を機械的に追い出すし、呼吸管や胃腸管の分泌粘液には微生物を捕らえ絡み取る働きがある。<ref>{{cite journal | author = Boyton R, Openshaw P |title=Pulmonary defences to acute respiratory infection |journal=Br Med Bull |volume=61 |issue=|pages=1--12 |year=2002|pmid= 11997295 |doi=10.1093/bmb/61.1.1}}</ref> |
|||
生化学的障壁も感染防御に働く。皮膚や呼吸管はβ-ディフェンシンのような抗微生物ペプチドを分泌する。<ref>{{cite journal | author = Agerberth B, Gudmundsson G |title=Host antimicrobial defence peptides in human disease |journal=Curr Top Microbiol Immunol |volume=306 |issue=|pages=67--90 |year=|DOI 10.1007/3-540-29916-5_3|pmid= 16909918 | doi = 10.1007/3-540-29916-5_3|pmid= 16909918}}</ref> 唾液、涙、母乳中のリソゾームやホスホリパーゼA2等の酵素も抗細菌物質である。<ref>{{cite journal | author = Moreau J, Girgis D, Hume E, Dajcs J, Austin M, O'Callaghan R |title=Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus | url=http://www.iovs.org/cgi/content/full/42/10/2347 |journal=Invest Ophthalmol Vis Sci |volume=42 |issue=10 |pages=2347--54 |year=2001 |pmid= 11527949}}</ref><ref>{{cite journal | author = Hankiewicz J, Swierczek E |title=Lysozyme in human body fluids |journal=Clin Chim Acta |volume=57 |issue=3 |pages=205--9 |year=1974 |pmid= 4434640 |doi=10.1016/0009-8981(74)90398-2}}</ref> 膣分泌液は初経後のわずかにでも酸性に傾いたとき化学的障壁として働くし、精液は病原体殺滅性のあるデフェンシンや亜鉛を含む。<ref>{{cite journal | author = Fair W, Couch J, Wehner N |title=Prostatic antibacterial factor. Identity and significance |journal=Urology |volume=7 |issue=2 |pages=169--77 |year=1976 |pmid= 54972 |doi=10.1016/0090-4295(76)90305-8}}</ref><ref>{{cite journal | author = Yenugu S, Hamil K, Birse C, Ruben S, French F, Hall S |title=Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli | url=http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1223422&blobtype=pdf |journal=Biochem J |volume=372 |issue=Pt 2 |pages=473--83 |year=2003 |pmid= 12628001 |doi=10.1042/BJ20030225}}</ref> 胃には胃酸およびタンパク質分解酵素があって、摂取された病原体に対して強力な化学的防御の働きがある。 |
|||
生殖尿管や胃腸管では共生細菌叢が病原菌と食物や繁殖場所をめぐって競争して生物学的障壁として働いている。この場合、pHや利用できるイオンのような環境を変えることもある。<ref>{{cite journal | author = Gorbach S |title=Lactic acid bacteria and human health |journal=Ann Med |volume=22 |issue=1 |pages=37--41 |year=1990 |pmid= 2109988 |doi=10.3109/07853899009147239}}</ref> このことは病原体が病気を起こすに至る十分な数まで増殖できる可能性を減らす。しかし大部分の抗生物質は細菌に対し非特異的に作用するし、カビには効かないので抗生物質を経口的に飲むとカビを異常に増殖させ、膣カンジダ症(真菌感染)のような症状を引き起こす。<ref>{{cite journal | author = Hill L, Embil J |title=Vaginitis: current microbiologic and clinical concepts | url=http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1490817&blobtype=pdf |journal=CMAJ |volume=134 |issue=4 |pages=321--31 |year=1986 |pmid= 3510698}}</ref> ヨーグルトに通常含まれている乳酸菌のような純粋カルチャーによって良性細菌叢を再導入することは、子供たちの腸管感染での微生物集団のバランスを健康なものに保つのを助ける働きがあるという証拠が出されている。これは細菌性胃腸炎、炎症性腸疾患、尿路感染症、術後感染の研究の予備的データに希望を与えている。<ref>{{cite journal |author=Reid G, Bruce A |title=Urogenital infections in women: can probiotics help? |url=http://pmj.bmj.com/cgi/content/full/79/934/428 |journal=Postgrad Med J |volume=79 |issue=934 |pages=428--32 |year=2003 |pmid=12954951 |doi=10.1136/pmj.79.934.428}}</ref><ref>{{cite journal | author = Salminen S, Gueimonde M, Isolauri E |title=Probiotics that modify disease risk | url=http://jn.nutrition.org/cgi/content/full/135/5/1294 |journal=J Nutr |volume=135 |issue=5 |pages=1294--8 |year=2005 |pmid= 15867327}}</ref><ref>{{cite journal |author=Reid G, Jass J, Sebulsky M, McCormick J |title=Potential uses of probiotics in clinical practice |journal=Clin Microbiol Rev |volume=16 |issue=4 |pages=658--72 |year=2003 |pmid=14557292 |doi=10.1128/CMR.16.4.658-672.2003}}</ref> |
|||
== 自然免疫 == |
|||
{{main|自然免疫系}} |
|||
微生物や毒性物質が生体内にうまく侵入できると、それらは生体細胞と接触し、自然免疫が発動する。この自然免疫応答は普通生体が微生物を構造パターン認識受容体で感知するときに発動する。この構造パターンは広い範囲の微生物グループの間で保存されている。<ref name="pmid17943118">{{cite journal |author=Medzhitov R |title=Recognition of microorganisms and activation of the immune response |journal=Nature |volume=449 |issue=7164 |pages=819--26 |year=2007 |pmid=17943118 |doi=10.1038/nature06246}}</ref> あるいは細胞は障害を受けると警戒シグナルを出す。それらの全てではないが多くは病原体を認識する同じ受容体によって感知される。<ref name="pmid11951032">{{cite journal |author=Matzinger P |title=the danger model: a renewed sense of self|journal=Science |volume=296 |issue=5566|pages=301-5 |year=2002|doi=10.1126/science.1071059}}</ref> Innate immune defenses are non-specific, meaning these systems respond to pathogens in a generic way.<ref name=Alberts/> 自然免疫系防御は非特異的である。つまり病原体に対して包括的な応答を行う。<ref name=Alberts/> この系は病原体に対し、長期間に渡って効く免疫はもたない。自然免疫系は大部分の生物にとって宿主防御の主要な系である。<ref name=Litman/> |
|||
=== 体液性および化学的障壁 === |
|||
==== 炎症 ==== |
|||
{{main|炎症}} |
|||
炎症は免疫系が感染に対し最初に起こす応答の一つである。<ref>{{cite journal | author = Kawai T, Akira S |title=Innate immune recognition of viral infection |journal=Nat Immunol |volume=7 |issue=2 |pages=131--7 |year=2006 |pmid= 16424890 |doi=10.1038/ni1303}}</ref> 炎症の徴候は発赤と腫れで、組織に流入する血液の増加によって起こされる。炎症は傷害や感染を受けた細胞が分泌するエイコサノイドとサイトカインによって生じる。エイコサノイドにはプロスタグランジンが含まれ、この物質は炎症に関係した場合、発熱と血管拡張を起こす。また同じくエイコサノイドに含まれるロイコトリエンはある種の白血球(リンパ球)に作用する。<ref>{{cite journal | author = Miller, SB |title=Prostaglandins in Health and Disease: An Overview |journal=Seminars in Arthritis and Rheumatism |volume=36 |issue=1 |pages=37--49|year=2006 |pmid= 16887467 |doi=10.1016/j.semarthrit.2006.03.005}}</ref><ref>{{cite journal | author = Ogawa Y, Calhoun WJ. |title=The role of leukotrienes in airway inflammation |journal=J Allergy Clin Immunol. |volume=118 |issue=4 |pages=789--98|year=2006 |pmid= 17030228 |doi=10.1016/j.jaci.2006.08.009}}</ref> 一般的なサイトカインとしては白血球間の情報伝達に関与したインタロイキン、走化性を増強するケモカイン、宿主細胞のタンパク質合成を停止させるようなウイルスに対して、抗ウイルス活性をもったインターフェロンなどがある。<ref>{{cite journal | author = Le Y, Zhou Y, Iribarren P, Wang J |title=Chemokines and chemokine receptors: their manifold roles in homeostasis and disease | url=http://www.nature.com/bjp/journal/v147/n1s/pdf/0706475a.pdf |journal=Cell Mol Immunol |volume=1 |issue=2 |pages=95--104 |year=2004 |pmid= 16212895}}</ref> 増殖因子や細胞毒性因子も分泌される場合がある。これらのサイトカインや他の化学物質は免疫細胞を感染部位に動員し、病原体を排除してから損傷を受けたいかなる組織も治癒が促進されるように作用する。<ref>{{cite journal | author = Martin P, Leibovich S |title=Inflammatory cells during wound repair: the good, the bad and the ugly |journal=Trends Cell Biol |volume=15 |issue=11 |pages=599--607 |year=2005 |pmid= 16202600 |doi=10.1016/j.tcb.2005.09.002}}</ref> |
|||
==== 補体系 ==== |
|||
{{main| 補体 }} |
|||
補体系は外来細胞の表面に攻撃を加える生化学的カスケードである。20以上のタンパク質が関与し、抗体による病原体殺滅を''補'' 強する能力をもつ、という意味で名づけられた。補体は自然免疫応答において主要な体液性要素をなす。<ref name=Rus>{{cite journal | author = Rus H, Cudrici C, Niculescu F |title=The role of the complement system in innate immunity |journal=Immunol Res |volume=33 |issue=2 |pages=103--12 |year=2005 |pmid= 16234578 |doi=10.1385/IR:33:2:103}}</ref><ref name=USCcomp>{{cite web | last = Mayer | first =Gene |title=Immunology - Chapter Two: Complement | work = Microbiology and Immunology On-Line Textbook | publisher = USC School of Medicine | date = 2006 |url=http://pathmicro.med.sc.edu/ghaffar/complement.htm | accessdate = 2007-01-01}}</ref> 補体系をもつ種は数多くあり、哺乳類以外にも、植物、魚類、それに無脊椎動物の数種がある。<ref name=Janeway6>{{cite book | author = [[Charles Janeway|Janeway CA, Jr.]] ''et al'' |title=Immunobiology. | edition = 6th ed. | publisher = Garland Science |year=2005 | id = ISBN 0-443-07310-4}}</ref> |
|||
ヒトではこの応答はこれら微生物に付着した抗体に補体が結合することにより、あるいは微生物の表面の炭水化物に補体タンパク質が結合することにより活性化される。この認識シグナルが、速やかな殺滅応答を発動する。<ref>{{cite journal | author = Liszewski M, Farries T, Lublin D, Rooney I, Atkinson J |title=Control of the complement system |journal=Adv Immunol |volume=61 |issue=|pages=201--83 |year=1996|pmid= 8834497 | doi = 10.1016/S0065-2776(08)60868-8}}</ref> 応答のスピードを決めるのは引き続いて起こる補体分子のタンパク質分解の活性化によって起こるシグナル増強の程度である。補体タンパク質自身もタンパク分解酵素である。補体タンパク質が微生物に付着した後、補体自身のタンパク分解酵素活性が発現し、続いて他の補体タンパク分解酵素が活性化され、これが連続して起こる。これは触媒反応カスケードを引き起こし、最初のシグナルを正のフィードバックでコントロールしながら増強するものである。<ref>{{cite journal | author = Sim R, Tsiftsoglou S |title=Proteases of the complement system | url=http://www.biochemsoctrans.org/bst/032/0021/0320021.pdf |journal=Biochem Soc Trans |volume=32 |issue=Pt 1 |pages=21--7 |year=2004 |pmid= 14748705 |doi=10.1042/BST0320021}}</ref> このカスケードはペプチドを賛成して免疫細胞を誘引し、血管の透過性を更新し、病原体の表面をオプソニン化(コート)して破壊できるようマークを付ける。補体がこうしてまとわりつくことによっても細胞膜は直接破壊され病原体は殺される。<ref name=Rus/> |
|||
=== 細胞障壁 === |
|||
[[Image:SEM blood cells.jpg|thumb|right|220px|正常のヒト循環[[血]]の[[走査電子顕微鏡]]写真。[[赤血球]]および突起物で覆われた少数のリンパ球を含んだ白血球を認め、ほかに[[単球]]、[[好中球]]、多数の小さな板状の[[血小板]]を認める。]] |
|||
白血球は独立した単細胞生物のように行動し、自然免疫系の右腕である。<ref name=Alberts/> 自然免疫系の白血球には貪食細胞(マクロファージ、好中球、および樹状細胞)、マスト細胞(肥満細胞)、好酸球、好塩基球、NK細胞が含まれる。これらの細胞はより大きな病原体に対してもそれを認識し排除するが、その際、接触して攻撃するか、あるいは微生物を呑み込んで殺滅する。<ref name=Janeway6/> これら自然免疫系細胞も、適応免疫系の活性化に重要なメディエータである。<ref name=USC/> |
|||
貪食機能は細胞性自然免疫で重要な役割をもっており、病原体や粒状物を呑み込み食す貪食細胞と呼ばれる細胞によって行われる。貪食細胞は一般に病原体を捜して体内をパトロールするが、サイトカインによって特定の部位に誘導される。<ref name=Alberts/> 病原体は一旦貪食細胞に呑み込まれるとファーゴソームと呼ばれる細胞内小胞によって捕らえられ、続いてリソソームと呼ばれる今一つ別の小胞と融合してファーゴリソソームを形成する。病原体は消化酵素によって、あるいは呼吸バーストに続くフリーラジカルのファーゴリソソームへの放出によって殺滅される。<ref>{{cite journal | author = Ryter A |title=Relationship between ultrastructure and specific functions of macrophages |journal=Comp Immunol Microbiol Infect Dis |volume=8 |issue=2 |pages=119--33 |year=1985 |pmid= 3910340 |doi=10.1016/0147-9571(85)90039-6}}</ref><ref>{{cite journal | author = Langermans J, Hazenbos W, van Furth R |title=Antimicrobial functions of mononuclear phagocytes |journal=J Immunol Methods |volume=174 |issue=1--2 |pages=185--94 |year=1994 |pmid= 8083520 |doi=10.1016/0022-1759(94)90021-3}}</ref> 貪食機能は栄養素獲得のために進化したが、貪食細胞ではこの役割が拡張されて病原体の貪食を含んだ防御機構として働く。<ref>{{cite journal | author = May R, Machesky L |title=Phagocytosis and the actin cytoskeleton | url=http://jcs.biologists.org/cgi/reprint/114/6/1061 |journal=J Cell Sci |volume=114 |issue=Pt 6 |pages=1061--77 |year=2001 |pmid= 11228151}}</ref> 貪食機能は、貪食細胞が脊椎動物にも無脊椎動物にも存在することから、おそらく宿主防御の最も古い形を示したものであろう。<ref>{{cite journal | author = Salzet M, Tasiemski A, Cooper E |title=Innate immunity in lophotrochozoans: the annelids |journal=Curr Pharm Des |volume=12 |issue=24 |pages=3043--50 |year=2006 |pmid= 16918433 |doi=10.2174/138161206777947551}}</ref> |
|||
好中球とマクロファージは侵入病原体を捜して体内全体を移動している貪食細胞である。<ref>{{cite journal | author = Zen K, Parkos C |title=Leukocyte-epithelial interactions |journal=Curr Opin Cell Biol |volume=15 |issue=5 |pages=557--64 |year=2003 |pmid= 14519390 |doi=10.1016/S0955-0674(03)00103-0}}</ref> 好中球は通常血流中に存在し、貪食細胞中最も豊富である。通常全循環白血球の50%~60%を占める。<ref name="IandF">{{cite book| last = Stvrtinova' | first = Viera | coauthors = Ja'n Jakubovsky' and Ivan Huli'n |title=''Inflammation and Fever'' from Pathophysiology: Principles of Disease | publisher = Academic Electronic Press | date = 1995 | location = Computing Centre, Slovak Academy of Sciences |url=http://web.archive.org/web/20010711220523/nic.savba.sk/logos/books/scientific/Inffever.html | accessdate = 2007-01-01}}</ref> 特に細菌感染の結果生じる炎症急性期には好中球は走化性というプロセスによって炎症部位に移動する。通常感染が生じた場面で最初に到着する細胞である。マクロファージは多才な細胞で、組織中に存在し、酵素、補体タンパク質、それにインターロイキン-1のような制御因子など広範囲にわたる化学物質を産生する。<ref name=USCmac>{{cite web | last = Bowers | first = William|title=Immunology -Chapter Thirteen: Immunoregulation | work = Microbiology and Immunology On-Line Textbook | publisher = USC School of Medicine | date = 2006|url=http://pathmicro.med.sc.edu/bowers/imm-reg.htm| accessdate = 2007-01-04}}</ref> マクロファージは死体・ゴミあさりの(スカベンジャー)細胞としても働き、体内の役に立たなくなった細胞、およびその他の崩壊沈着物の除去および適応免疫系を活性化する抗原提示細胞として働く。<ref name=USC/> |
|||
樹状細胞(DC; dendritic cell)は外界に接する組織中の貪食細胞である。したがってこの細胞は主に皮膚、鼻、肺、胃、および腸に存在する。<ref name=Guermonprez>{{cite journal | author = Guermonprez P, Valladeau J, Zitvogel L, The'ry C, Amigorena S |title=Antigen presentation and T cell stimulation by dendritic cells |journal=Annu Rev Immunol |volume=20 |issue=|pages=621--67 |year=2002|pmid= 11861614 |doi=10.1146/annurev.immunol.20.100301.064828}}</ref> この細胞の名称は神経細胞の樹状突起(dendrite)に似ていることから付けられた。両方とも樹状突起を多数もっているが、樹状細胞は神経系につながるすべは全くもたないのだが。樹状細胞はT細胞に抗原を提示するので、体内の組織と自然免疫系および適応免疫系への橋渡しをする役割がある。T細胞は適応免疫系の鍵となる細胞タイプの一つである。<ref name=Guermonprez/> |
|||
マスト細胞(肥満細胞)は結合組織および粘性膜に存在し、炎症応答を制御する。<ref>{{cite journal | author = Krishnaswamy G, Ajitawi O, Chi D |title=The human mast cell: an overview |journal=Methods Mol Biol |volume=315 |issue=|pages=13--34 |year=|pmid= 16110146}}</ref> この細胞は最も多くはアレルギーとアナフィラキシーに関与する。<ref name="IandF"/> 好塩基球と好酸球は好中球の関連細胞で、寄生虫に対する防御の際に化学メディエータを分泌し、喘息のようなアレルギー反応に係わる。<ref>{{cite journal | author = Kariyawasam H, Robinson D |title=The eosinophil: the cell and its weapons, the cytokines, its locations |journal=Semin Respir Crit Care Med |volume=27 |issue=2 |pages=117--27 |year=2006 |pmid= 16612762 |doi=10.1055/s-2006-939514}}</ref> ナチュラルキラー細胞(NK細胞)は腫瘍細胞あるいはウイルス感染症腺細胞を攻撃して破壊する。<ref>{{cite journal | author = Middleton D, Curran M, Maxwell L |title=Natural killer cells and their receptors |journal=Transpl Immunol |volume=10 |issue=2--3 |pages=147--64 |year=2002 |pmid= 12216946 |doi=10.1016/S0966-3274(02)00062-X}}</ref> |
|||
== 適応免疫 == |
|||
適応免疫系は初期の脊椎動物に進化し、より強力な免疫反応を起こし、個々の病原体が特定の型であることを示す抗原によって記憶される免疫記憶を保持する。<ref>{{cite journal | author = Pancer Z, Cooper M |title=The evolution of adaptive immunity |journal=Annu Rev Immunol |volume=24 |issue=|pages=497--518 |year=2006|pmid= 16551257 |doi=10.1146/annurev.immunol.24.021605.090542}}</ref> 適応免疫応答は抗原特異的であり、抗原提示と呼ばれるプロセスの間に特異的な非自己の抗原であるという認識が行われる必要がある。抗原特異性の認識によって、特定の病原体あるいは特定の病原体感染細胞に対して調整された応答の発動を可能とする。このような調整された応答を開始する能力は体内の記憶細胞によって保持される。もし病原体が1回以上生体に感染するなら、このような特定の記憶細胞が使われて即座に病原体は排除される。 |
|||
=== リンパ球 === |
|||
適応免疫系の細胞は特定の型の白血球であり、リンパ球と呼ばれる。リンパ球の主要なタイプの細胞はB細胞とT細胞であり、骨髄中の造血幹細胞に由来する。<ref name=Janeway6/> B細胞は体液性免疫応答に関与し、T細胞は細胞性免疫応答に関与する。[[Image:TCR-MHC bindings.png|thumb|220px|left|T細胞とMHCクラスⅠあるいはMHCクラスⅡと抗原(赤色)との会合を示す]] |
|||
B細胞もT細胞も特異的なターゲット抗原を認識する受容体分子をもっている。T細胞は抗原(病原体の小さな断片)が加工されて''自己の''受容体である主要組織適合遺伝子複合体(MHC、''M''ajor ''H''istocompatibility ''C''omplex)分子と組み合わさって提示されて初めて病原体のような''非自己の''ターゲットを認識する。T細胞のサブタイプには主要な2つのタイプがある。キラーT細胞とヘルパーT細胞である。キラーT細胞はクラスⅠMHC分子と結合した抗原のみを認識し、ヘルパーT細胞はクラスⅡMHC分子と結合した抗原のみを認識する。抗原提示におけるこの2つの機構はT細胞2タイプの機能の違いに原因がある。3番目のマイナーなサブタイプのT細胞としてγδT細胞があり、MHC受容体に結合しない、非加工の抗原を認識する。<ref>{{cite journal | author = Holtmeier W, Kabelitz D |title=gammadelta T cells link innate and adaptive immune responses |journal=Chem Immunol Allergy |volume=86 |issue=|pages=151--83 |year=|pmid= 15976493}}</ref> |
|||
対照的にB細胞の抗原特異的受容体はB細胞表面上の抗体分子であり、抗原加工を全く必要とせず、病原体全体を認識する。B細胞の増殖系はそれぞれ異なった抗体を発現し、B細胞の抗原受容体の完全な1セットは生体が生成可能な全ての抗体を表すものである。<ref name= Janeway6/> |
|||
[[Image:Cytotoxic T cell-ja.jpg|thumb|200px|right|キラーT細胞が外来性ないし異常な抗原を表面にもった細胞に直接攻撃を加えている。<ref name=NIAID>{{cite web |title=Understanding the Immune System: How it Works | publisher = [[National Institute of Allergy and Infectious Diseases]] (NIAID) |url=http://www.niaid.nih.gov/publications/immune/the_immune_system.pdf | format = [[PDF]] | accessdate = 2007-01-01}}</ref>]] |
|||
==== キラーT細胞<!-- <ref>ノートにキラーT細胞は最近細胞傷害性T細胞と呼ばれることが多いとの指摘がありますが、ここでは英語版にしたがって「キラーT細胞」を使います。</ref> --> ==== |
|||
キラーT細胞はT細胞のサブグループであって、ウイルス(および他の病原体)に感染した細胞を殺滅する。これがなされない場合損傷を与え機能不全をもたらす。<ref>{{cite journal | author = Harty J, Tvinnereim A, White D |title=CD8+ T cell effector mechanisms in resistance to infection |journal=Annu Rev Immunol |volume=18 |issue=|pages=275--308 |year=2000|pmid= 10837060 |doi=10.1146/annurev.immunol.18.1.275}}</ref> B細胞で行われているように各T細胞タイプは異なる抗原を認識する。キラーT細胞はT細胞受容体がこの特定の抗原が他の細胞のMHCクラスⅠ受容体と複合体を作っているときに抗原と結合する。このMHC-抗原複合体はT細胞上のCD8と呼ばれるコレセプターの助けを得て認識される。したがってこのT細胞はこのような抗原を保持したMHCⅠ受容体を発現させている細胞を捜して、体内をくまなく移動する。活性化したT細胞がこのような細胞と接触するとT細胞はパーフォリンのようなサイトカインを放出する。パーフォリンはターゲット細胞の細胞膜に穴を開け、イオンや水分さらに毒性物質を侵入させる。グラニュライシン(タンパク分解酵素)と呼ばれるほかの毒性物質の侵入はターゲット細胞にアポトーシスを誘導する。<ref name=Radoja>{{cite journal | author = Radoja S, Frey A, Vukmanovic S |title=T-cell receptor signaling events triggering granule exocytosis |journal=Crit Rev Immunol |volume=26 |issue=3 |pages=265--90 |year=2006 |pmid= 16928189}}</ref> T細胞による宿主細胞の殺滅は、ウイルスの増殖を妨害する上で特に重要である。T細胞の活性化は強く制御されており、一般にきわめて強力なMHC/抗原の活性シグナルを必要とする。あるいは付加的な活性シグナルはヘルパーT細胞から供される(下記参照)。<ref name=Radoja/> |
|||
==== ヘルパーT細胞 ==== |
|||
[[Image:Lymphocyte activation simple-ja.png|thumb|right|300px|Tヘルパー細胞の機能:抗原提示細胞(APC)はクラスⅡMHC分子(MHC2)上に抗原を提示する。ヘルパーT細胞はこれを認識し、これはCD4コレセプター([[CD4]]<sup>+</sup>)の助けを得る。静止期ヘルパーT細胞の活性化によってサイトカインや他の刺激シグナル(緑の矢印)が放出され、膜、キラーT細胞、およびB細胞の活性を刺激する。B細胞への刺激は抗体産生につながる。B細胞とマクロファージへの刺激はTヘルパー細胞の増殖後に行われる。]] |
|||
ヘルパーT細胞は自然免疫系も適応免疫系も制御する。そして生体が特定の病原体に対して応答するのにどちらのタイプを用いるかを決定するのを助ける。<ref>{{cite journal | author = Abbas A, Murphy K, Sher A |title=Functional diversity of helper T lymphocytes |journal=Nature |volume=383 |issue=6603 |pages=787--93 |year=1996 |pmid= 8893001 |doi=10.1038/383787a0}}</ref><ref>{{cite journal | author = McHeyzer-Williams L, Malherbe L, McHeyzer-Williams M |title=Helper T cell-regulated B cell immunity |journal=Curr Top Microbiol Immunol |volume=311 |issue=|pages=59--83 |year=2006|pmid= 17048705 | doi = 10.1007/3-540-32636-7_3}}</ref> このT細胞は細胞毒性活性は全くもたず、感染細胞を殺滅したり、病原体を直接排除しない。代わりに他の細胞がそのような仕事をするよう方向付けて免疫系を制御する。 |
|||
ヘルパーT細胞もT細胞受容体(TCR)を発現し、クラスⅡMHCと結合した抗原を認識する。MHC:抗原複合体はヘルパーT細胞のCD4コレセプターによっても認識され、T細胞活性化に作用するT細胞内の分子(例えばLck)を動員する。ヘルパーT細胞のMHC:抗原複合体との会合はキラーT細胞より弱い。このことはヘルパーT細胞の活性化にT細胞上の多くの受容体(200~300個)が結合しなければならないことを意味している。一方キラーT細胞の場合は1個のMHC:抗原分子が関与すると活性化できる。ヘルパーT細胞の活性化には抗原提示細胞とのいっそう長い相互作用をも必要とする。<ref>{{cite journal | author = Kovacs B, Maus M, Riley J, Derimanov G, Koretzky G, June C, Finkel T |title=Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation | url=http://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&uid=12419850&cmd=showdetailview |journal=Proc Natl Acad Sci U S a |volume=99 |issue=23 |pages=15006--11 |year=2002 |pmid= 12419850 |doi=10.1073/pnas.232058599}}</ref> 静止期ヘルパーT細胞が活性化されると他の多くの細胞タイプの活性が影響を受けるサイトカインが放出される。ヘルパーT細胞によってもたらされるサイトカインシグナルはマクロファージの微生物殺滅作用を増強し、キラーT細胞の活性も増強する。<ref name= Alberts/> 加えてヘルパーT細胞の活性化はT細胞表面の分子CD40(CD154とも呼ばれる)などの発現を増強制御する。この分子は抗体産生B細胞を活性化するのに必要な代表的な付加的刺激シグナルとして働く。<ref>{{cite journal | author = Grewal I, Flavell R |title=CD40 and CD154 in cell-mediated immunity |journal=Annu Rev Immunol |volume=16 |issue=|pages=111--35 |year=1998|pmid= 9597126 |doi=10.1146/annurev.immunol.16.1.111}}</ref> |
|||
==== γδT細胞 ==== |
|||
γδT細胞はCD4<sup>+</sup>およびCD8<sup>+</sup>(αβ)T細胞とは対照的に別のT細胞受容体(TCR)をもち、ヘルパーT細胞、細胞傷害性T細胞、およびNK細胞と同じ性質を共有する。γδT細胞から応答を得る条件は完全には解明されていない。他のなじみのない変異型TCRをもったT細胞サブセット、例えばCD1d-限定ナチュラルキラーT細胞などと同様に、自然免疫と適応免疫の間を広くまたいでいる。<ref>{{cite journal | author = Girardi M |title=Immunosurveillance and immunoregulation by γδ T cells |journal=J Invest Dermatol |volume=126 |issue=1 |pages=25--31 |year=2006 |pmid= 16417214 |doi=10.1038/sj.jid.5700003}}</ref> 一方でγδT細胞は、この細胞はTCR遺伝子を再編成して受容体の多様性を生じること、そして記憶表現型も発達させることができることから、適応免疫の要素である。他方様々なサブセットは、制限されたTCRあるいはNK受容体が受容体のパターン認識に用いられることがあるため、自然免疫系の一部分をなす。例えばきわめて多数のヒトVγ9/Vδ2 T細胞は微生物によって産生される共通の分子に対して数時間以内に応答する。さらに高度に制限されたVδ1<sup>+</sup> |
|||
T細胞は上皮細胞が受けるストレスに応答するようだ。<ref>{{cite journal | author = Holtmeier W, Kabelitz D |title=γδ T cells link innate and adaptive immune responses |journal=Chem Immunol Allergy |volume=86 |pages=151--183 |year=2005 |pmid= 15976493 | doi = 10.1159/000086659}}</ref> |
|||
[[Image:Antibody-ja.JPG|thumb|220px|right|2本の重鎖と2本の軽鎖から形成された抗体分子。ユニークな可変部は抗体による対応する抗原の認識を可能にする。<ref name=NIAID/>]] |
|||
==== Bリンパ球と抗体 ==== |
|||
1個のB細胞は表面上の抗体が特定の外来抗原に結合すると病原体を認識することになる。<ref name=Sproul>{{cite journal | author = Sproul T, Cheng P, Dykstra M, Pierce S |title=A role for MHC class II antigen processing in B cell development |journal=Int Rev Immunol |volume=19 |issue=2--3 |pages=139--55 |year=2000 |pmid= 10763706 |doi=10.3109/08830180009088502}}</ref> この抗原/抗体複合体はB細胞によって取り込まれタンパク質分解プロセスによってペプチドにされる。B細胞は次にこれら抗原ペプチドをMHCⅡ分子上に提示する。MHCと抗原の複合体は対応するヘルパーT細胞を誘導し、B細胞を活性化するリンフォカインを放出する。<ref>{{cite journal | author = Kehry M, Hodgkin P |title=B-cell activation by helper T-cell membranes |journal=Crit Rev Immunol |volume=14 |issue=3--4 |pages=221--38 |year=1994 |pmid= 7538767}}</ref> B細胞が活性化されて増殖のための分裂を始めるとその子孫(形質細胞)はこの抗原を認識する抗体コピーを何百万分子も分泌する。これらの抗体は血漿およびリンパ球に入って循環しこの抗原を発現している病原体に結合し、補体系の活性化あるいは貪食細胞による取り込みと破壊が起きるようマークを付ける。抗体は侵入病原体に対し、細菌の毒素に結合したりウイルスや細菌が細胞に感染する際に利用する受容体に妨害作用を及ぼして、直接中和することもできる。<ref name=USCcells>{{cite web | last =Bowers | first = William |title=Immunology - Chapter nine: Cells involved in immune responses| work = Microbiology and Immunology On-Line Textbook | publisher = USC School of Medicine | date = 2006|url=http://pathmicro.med.sc.edu/bowers/immune%20cells.htm | accessdate = 2007-01-04}}</ref> |
|||
==== 代替的適応免疫系 ==== |
|||
適応免疫の古典的な分子(例えば抗体やT細胞受容体)は顎をもった脊椎動物のみに存在するにも拘わらず、ヤツメウナギやメクラウナギのような原始的な無顎脊椎動物には独特なリンパ球由来の分子が発見されている。これらの動物には変異性リンパ球受容体(VLRs)と呼ばれる大きな一群の分子が備わり、顎をもった脊椎動物の抗原受容体のようにごくわずかな数(1つか2つ)の遺伝子のみから産生される。これらの分子は抗体と同じやり方で病原体の抗原に抗体と同じ程度の特異性をもって結合すると信じられている。<ref>{{cite journal | author = M.N. Alder, I.B. Rogozin, L.M. Iyer, G.V. Glazko, M.D. Cooper, Z. Pancer |title=Diversity and Function of Adaptive Immune Receptors in a Jawless Vertebrate |journal=Science|volume=310 |issue=5756 |pages=1970--1973 |year=2005 |pmid= 16373579 |doi=10.1126/science.1119420}}</ref> |
|||
=== 免疫記憶 === |
|||
{{main|免疫(医学)}} |
|||
B細胞とT細胞が活性化されて複製を始めるとそれらの子孫細胞の中には長期間体内に残存する記憶細胞になるものがあるだろう。動物の生涯にわたってこれらの記憶細胞は各々の特異的な病原体に出合った記憶を保持し、病原体が再び感知されると強力な応答を発動できる。これは、個体の生涯にわたって病原体による感染に適応して起こり、免疫系が将来の接触に対して準備するものであるから、「適応」であると言える。免疫記憶は短期間の受動的な記憶の形か長期間にわたる能動的な記憶の形かのいずれかで成立しうる。 |
|||
==== 受動的な記憶 ==== |
|||
新生児はあらかじめ微生物に接触することはなく特に感染を受けやすい。そこで母親からいくつかの階層からなる受動防御が提供される。妊娠中抗体の特別の型IgGが胎盤を経由して直接母親から胎児に輸送される。したがってヒト新生児は誕生時すでに高レベルの母親と同じ抗原特異性の幅を持った抗体をもっている。<ref>{{cite journal | author = Saji F, Samejima Y, Kamiura S, Koyama M |title=Dynamics of immunoglobulins at the feto-maternal interface | url=http://ror.reproduction-online.org/cgi/reprint/4/2/81.pdf |journal=Rev Reprod |volume=4 |issue=2 |pages=81--9 |year=1999 |pmid= 10357095 |doi=10.1530/ror.0.0040081}}</ref> 母乳も抗体をもっており赤ん坊の胃に移動し、新生児が自分自身の抗体を合成できるまで、細菌感染を防御する。<ref>{{cite journal | author = Van de Perre P |title=Transfer of antibody via mother's milk |journal=Vaccine |volume=21 |issue=24 |pages=3374--6 |year=2003 |pmid= 12850343 |doi=10.1016/S0264-410X(03)00336-0}}</ref> これは受動免疫であって、胎児は実際記憶細胞あるいは抗体を作らずそれらを母親から借用するだけであるから、この受動免疫は普通短期間のもので、数日から数カ月しか続かない。医学では、防御的な受動免疫が、ある個人から他人へ抗体リッチな血清を人工的に移すことでも行いうる。<ref name= Keller>{{cite journal | author = Keller, Margaret A. and E. Richard Stiehm |title=Passive Immunity in Prevention and Treatment of Infectious Diseases | url=http://cmr.asm.org/cgi/content/full/13/4/602 |journal=Clinical Microbiology Reviews|volume=13 |issue=4 |pages=602--614 |year=2000 |pmid= 11023960 |doi=10.1128/CMR.13.4.602-614.2000}}</ref> |
|||
[[Image:Immune response-ja.jpg|thumb|left|360px|免疫応答が病原体の感染(あるいはワクチン初回投与)から始まり能動的な免疫記憶を形成して維持される時間的経過。]] |
|||
==== 能動的な記憶と免疫処置 ==== |
|||
長期的な''能動的な''記憶は感染後BおよびT細胞の活性化によって獲得される。能動免疫は人工的にもワクチン接種によって成立させ得る。ワクチン接種(あるいは免疫処置と呼ばれる)の原理は病原体の抗原を導入し免疫系を刺激してその特定の病原体に対する特異的免疫を発達させその病原体由来の病気を起こさないようにすることである。<ref name=Alberts/> この意図的な免疫応答の誘導は免疫系が自然に作り出している特異性を利用していること、そうして免疫を誘導できるということによって成功している。ヒト集団の主要な死因の一つに感染症があることからワクチン処置は人類が発展させた免疫系の操作の中で最も効果のあるものである。<ref>[http://www.who.int/healthinfo/bod/en/index.html Death and DALY estimates for 2002 by cause for WHO Member States.] [[World Health Organization]]. Retrieved on [[2007-01-01]].</ref><ref name=Janeway6/> |
|||
大部分のウイルスワクチンは生きた弱毒化したウイルスをもとにしているが多くの細菌ワクチンは有害作用のない毒物質の成分など細菌の構成要素の非細胞成分をもとにしている。<ref name=Alberts/> 多くの非細胞成分由来の抗原によるワクチンはあまり適応免疫応答を起こさないため、大部分の細菌ワクチンは、自然免疫の抗原提示細胞を活性化し免疫原性を最大にするアジュバンドを添加して提供される。<ref>{{cite journal | author = Singh M, O'Hagan D |title=Advances in vaccine adjuvants |journal=Nat Biotechnol |volume=17 |issue=11 |pages=1075--81 |year=1999 |pmid= 10545912 |doi=10.1038/15058}}</ref> |
|||
== ヒトの免疫異常 == |
|||
免疫系は、特異性、誘導性、および適応性を取り込んできわめて効果的な構造をもつに至っている。しかし宿主防御に失敗することがあり、これは3つの大まかなカテゴリーに分けられる。免疫不全、自己免疫、過敏症、である。 |
|||
=== 免疫不全 === |
|||
{{main| 免疫不全 }} |
|||
免疫不全は免疫系の1つないしそれ以上の要素が機能しない場合に起きる。免疫系が病原体に対して応答する能力は、若くても年を取っても減退する。免疫応答は50才位から免疫老化のために衰え始める。<ref>{{cite journal |author=Aw D, Silva A, Palmer D |title=Immunosenescence: emerging challenges for an ageing population |journal=Immunology |volume=120 |issue=4 |pages=435--446 |year=2007 |pmid=17313487 |doi=10.1111/j.1365-2567.2007.02555.x}}</ref><ref name="nutrition">{{cite journal| last = Chandra | first = RK|title=Nutrition and the immune system: an introduction |journal=American Journal of Clinical Nutrition |volume=Vol 66 |pages=460S--463S | date = 1997 |pmid= 9250133 |url = http://www.ajcn.org/cgi/content/abstract/66/2/460S}} Free '''full-text pdf''' available</ref> 先進国では肥満、アルコール依存症、薬物使用は免疫機能を弱める共通の原因である。<ref name="nutrition"/> しかし開発途上国では栄養不良が免疫不全の最も多く見られる原因である。<ref name="nutrition"/> 十分なタンパク質を取らないダイエットは細胞性免疫や補体活性、貪食細胞機能、IgA抗体濃度、サイトカイン産生を損なう。栄養素であるイオン、銅、亜鉛、セレン、ビタミンA、C、E、B<sub>6</sub>、葉酸(ビタミンB<sub>9</sub>)が1つでも欠乏したら免疫応答は減退する。<ref name="nutrition"/> 加えて若いときに胸腺を遺伝的突然変異の原因か手術による摘出で失うと、重症の免疫不全を起こし、感染性が非常に高くなる。<ref>{{cite journal |author=Miller JF |title=The discovery of thymus function and of thymus-derived lymphocytes |url=http://www.blackwell-synergy.com/doi/abs/10.1034/j.1600-065X.2002.18502.x |journal=Immunol. Rev. |volume=185 |issue= |pages=7--14 |year=2002 |pmid=12190917 |doi=}}</ref> |
|||
免疫不全は遺伝でも後天的でも生じうる。<ref name=Alberts/> 慢性肉芽腫症では、貪食細胞の病原体破壊力が弱いということがあるが、遺伝性または先天性の免疫不全の例であるAIDSやいくつかのがんの型は、後天的な免疫不全を起こす。<ref>{{cite journal | author = Joos L, Tamm M |title=Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy | url=http://pats.atsjournals.org/cgi/content/full/2/5/445 |journal=Proc Am Thorac Soc |volume=2 |issue=5 |pages=445--8 |year=2005 |pmid= 16322598 |doi=10.1513/pats.200508-097JS}}</ref><ref>{{cite journal | author = Copeland K, Heeney J |title=T helper cell activation and human retroviral pathogenesis | url=http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=239461&blobtype=pdf |journal=Microbiol Rev |volume=60 |issue=4 |pages=722--42 |year=1996 |pmid= 8987361}}</ref> |
|||
=== 自己免疫 === |
|||
{{main| 自己免疫 }} |
|||
免疫応答の亢進は特に自己免疫病のような免疫不全の一方の極端をなす。ここでは免疫系は、自己と非自己を的確に区別できないで、自己の身体部分を攻撃する。普通の状態では多くのT細胞を抗体は自己のペプチドと反応する。<ref>{{cite journal | author = Miller J |title=Self-nonself discrimination and tolerance in T and B lymphocytes |journal=Immunol Res |volume=12 |issue=2 |pages=115--30 |year=1993 |pmid= 8254222 |doi=10.1007/BF02918299}}</ref> 特別な細胞(胸腺および骨髄に潜む)の機能の1つに若いリンパ球に体内で産生されている自己抗原を提示し、自己抗原と認識した細胞を排除して自己免疫を防いでいる。<ref name=Sproul/> |
|||
=== 過敏症 === |
|||
過敏症は自己の組織に損傷を与える免疫応答である。これは機構と過敏反応が起きる時間経過に基づいて、4クラスに分けられる。Ⅰ型過敏症は即時的な反応あるいはアナフィラキシー反応で、しばしばアレルギーに付随している。症状は穏やかな不快さから死に至るまで幅広い。Ⅰ型過敏症はマスト細胞や好塩基球が分泌するIgEが原因である。<ref name=USCH>{{cite web | last = Ghaffar | first = Abdul |title=Immunology - Chapter Seventeen: Hypersensitivity Reactions | work = Microbiology and Immunology On-Line Textbook | publisher = USC School of Medicine | date = 2006 |url=http://pathmicro.med.sc.edu/ghaffar/hyper00.htm | accessdate = 2007-01-01 }}</ref> Ⅱ型過敏症は抗体が自己の細胞の抗原に結合してそれを破壊するようマークを付けることから起こる。これは抗体依存性(あるいは細胞傷害性)過敏症と呼ばれ、IgGやIgM抗体が原因である。<ref name=USCH/> 免疫複合体(抗原の凝集、補体タンパク質、およびIgGとIgM抗体)が様々な組織で沈着するとⅢ型過敏症の反応が引き起こされる。<ref name=USCH/> Ⅳ型過敏症は(細胞媒介性あるいは遅延型過敏症としても知られるが)生じるまでに普通は2~3日かかる。Ⅳ型の反応は多くの自己免疫病や感染症で見られるが、接触皮膚炎(ツタウルシ)にも見られる場合がある。これらの反応に関与しているのはT細胞、単球およびマクロファージである。<ref name=USCH/> |
|||
== 他の機構 == |
|||
無脊椎動物はリンパ球を生み出していないし、抗体に基づいた体液性反応も生み出していないので多要素からなる適応免疫系は最初の脊椎度物に生じたと思われる。<ref name=Beck/> しかし多くの種は脊椎度物の免疫のこれらの諸面の前駆機能として発現させている機構を活用している。免疫系は生物の機能構造としては最も簡単なものでさえあると見受けられる。細菌はバクテリオファージと呼ばれるウイルス病原体から守るために制限修飾系と呼ばれるユニークな防御機構を用いている。<ref>{{cite journal | author = Bickle T, Kru"ger D |title=Biology of DNA restriction | url=http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=372918&blobtype=pdf |journal=Microbiol Rev |volume=57 |issue=2 |pages=434--50 |year=1993 |pmid=8336674}}</ref> 原核生物も獲得免疫系をもっており、過去に接触したファージのゲノム断片を保持するのにCRISPR配列を用いてRNA干渉のような形でウイルスの複製を妨害することができる。<ref>{{cite journal |author=Barrangou R, Fremaux C, Deveau H, ''et al'' |title=CRISPR provides acquired resistance against viruses in prokaryotes |journal=Science (journal) |volume=315 |issue=5819 |pages=1709--12 |year=2007 |month=March |pmid=17379808 |doi=10.1126/science.1138140}}</ref><ref>{{cite journal |author=Brouns SJ, Jore MM, Lundgren M, ''et al'' |title=Small CRISPR RNAs guide antiviral defense in prokaryotes |journal=Science (journal) |volume=321 |issue=5891 |pages=960--4 |year=2008 |month=August |pmid=18703739 |doi=10.1126/science.1159689}}</ref> |
|||
パターン認識受容体は病原体に付随した分子を感知するのにほとんど総ての生物によって利用されている。ディフェンシンと呼ばれる抗微生物ペプチドは全ての動物および植物に見られる自然免疫応答の進化的に保存された要素の1つである。<ref name=Beck/> 補体系や貪食細胞も大部分の無脊椎動物で利用されている。リボヌクレアーゼとRNA干渉の反応経路は全ての真核生物で保存されていてウイルスに対する免疫応答に役割を果たしていると考えられる。<ref>{{cite journal | author = Stram Y, Kuzntzova L. |title=Inhibition of viruses by RNA interference |journal=Virus Genes |volume=32|issue=3 |pages=299--306 |year=2006 |pmid=16732482 |doi=10.1007/s11262-005-6914-0}}</ref> |
|||
動物と違い植物では貪食細胞を欠く。植物の大部分の免疫応答には植物から放出される全身的な化学的シグナルがある。<ref name= Plant>{{cite web | last = Schneider | first = David |title=Innate Immunity - Lecture 4: Plant immune responses| publisher = Stanford University Department of Microbiology and Immunology | date = Spring 2005 |url=http://cmgm.stanford.edu/micro/Schneider-lab/Innate%20immunity%20course.html | accessdate = 2007-01-01}}</ref> 植物の一部が感染を受けるとその植物は局所的な過敏性の反応を起こす。そのことによって感染部位の細胞は速やかなアポトーシスを起こし他の植物への感染の広がりを阻止する。[[全身獲得抵抗性]]([[:en:SAR|SAR]]; ''S''ystemic ''A''cquired ''R''esistance)は防御反応の1つの型で、植物全体が特定の感染性病原体に抵抗するようにする。<ref name= Plant/> RNAサイレンシング機構はウイルス複製をブロックできるのでこの全身的応答に特に重要である。<ref>{{cite journal | author = Baulcombe D |title=RNA silencing in plants |journal=Nature |volume=431 |issue=7006 |pages=356--63 |year=2004 |pmid=15372043 |doi=10.1038/nature02874}}</ref> |
|||
== 腫瘍免疫 == |
|||
[[Image:Macs killing cancer cell.jpg|thumb|right|250px |
|||
|[[マクロファージ]](白い小さな細胞)ががん細胞(突起をたくさんもった大きな塊)を認識したところ。マクロファージは腫瘍細胞を殺す毒物を注入するだろう。がん治療における免疫療法は活発な医学研究領域の1つである。 |
|||
<ref>{{cite journal | author = Morgan R ''et al''. |title=Cancer regression in patients after transfer of genetically engineered lymphocytes |journal=[[Science (journal)|Science]] |year=2006 |volume=314 |pages=126--129 |pmid=16946036 |doi=10.1126/science.1129003}}</ref>]] |
|||
免疫系の他の重要な役割に腫瘍を見つけて排除することがある。腫瘍による形質転換細胞は正常細胞にない抗原を発現する。免疫系にとってこれらの抗原は非自己に見え、免疫細胞は形質転換した腫瘍細胞を攻撃する。腫瘍によって発現する抗原にはいくつかのソースがある。子宮頚がんを起こすヒトパピローマウイルスのような発がん性ウイルス由来のもの。<ref name = anderson>{{cite journal | author = Andersen MH, Schrama D, Thor Straten P, Becker JC |title=Cytotoxic T cells |journal=J Invest Dermatol |volume=126 |issue=1 |pages=32--41 |year=2006 |pmid=16417215 |doi=10.1038/sj.jid.5700001}}</ref> <ref>{{cite journal | author = Boon T, van der Bruggen P |title=Human tumor antigens recognized by T lymphocytes |journal=J Exp Med |volume=183 |issue=|pages=725--29 |year=1996 |pmid=8642276 |doi=10.1084/jem.183.3.725 }}</ref> 他は正常細胞では低レベルにしか見られないが腫瘍細胞で高レベルで見られるような自己タンパク質である。1例としてチロシナーゼと呼ばれる酵素があり、これは高レベルに発現するとある種の皮膚細胞(例えばメラノサイト)をメラノーマと呼ばれる腫瘍細胞に転換させる。<ref>{{cite journal | author = Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G |title=T cell recognition of melanoma-associated antigens |journal=J Cell Physiol |volume=182 |issue=|pages=323--31 |year=2000 |pmid= 10653598 |doi=10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-# }}</ref><ref name = romera>{{cite journal | author = Romero P, Cerottini JC, Speiser DE |title=The human T cell response to melanoma antigens |journal=Adv Immunol. |volume=92 |issue=|pages=187--224 |year=2006 |pmid=17145305 | doi = 10.1016/S0065-2776(06)92005-7}}</ref> 腫瘍抗原の3番目の可能なソースは正常細胞では細胞増殖や生存の制御に重要なタンパク質が普通に突然変異を起こしてがん誘起分子に変わる。<ref name = anderson/><ref name = guevara>{{cite journal | author = Guevara-Patino JA, Turk MJ, Wolchok JD, Houghton AN |title=Immunity to cancer through immune recognition of altered self: studies with melanoma |journal=Adv Cancer Res. |volume=90 |issue=|pages=157--77 |year=2003 |pmid= 14710950 | doi = 10.1016/S0065-230X(03)90005-4}}</ref><ref>{{cite journal | author = Renkvist N, Castelli C, Robbins PF, Parmiani G |title=A listing of human tumor antigens recognized by T cells |journal=Cancer Immunol Immunother |volume=50 |issue=|pages=3--15 |year=2001 |pmid=11315507 |doi=10.1007/s002620000169}}</ref> |
|||
免疫系の腫瘍に対する主な反応は異常細胞をキラーT細胞やときにヘルパーT細胞の補助を受けて破壊することである。<ref name = romera/><ref>{{cite journal | author = Gerloni M, Zanetti M. |title=CD4 T cells in tumor immunity |journal=. Springer Semin Immunopathol |volume=27 |issue=1 |pages=37--48 |year=2005 |pmid=15965712 |doi=10.1007/s00281-004-0193-z }}</ref> 腫瘍抗原はウイルス抗原と同じようにMHCクラスⅠ分子上に提示される。これによってキラーT細胞は腫瘍細胞を異常と見なす。<ref name = seliger>{{cite journal | author = Seliger B, Ritz U, Ferrone S |title=Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation |journal=Int J Cancer |volume=118 |issue=1 |pages=129--38|year=2006 |pmid=16003759 |doi=10.1002/ijc.21312 }}</ref> NK細胞も同じように腫瘍性の細胞を殺滅し特にMHCクラスⅠ分子が正常に比べ少なく発現されている腫瘍細胞に対して作用する。このことは腫瘍細胞では一般的な現象として見られることである。<ref>{{cite journal | author = Hayakawa Y, Smyth MJ. |title=Innate immune recognition and suppression of tumors |journal=Adv Cancer Res |volume=95 |issue=|pages=293--322 |year=2006 |pmid=16860661 |doi=10.1016/S0065-230X(06)95008-8 }}</ref> 往々にして腫瘍細胞に対して抗体が産生され補体系にもそれらの細胞を破壊することが図られる。<ref name = guevara/> |
|||
明らかに腫瘍の中には免疫系をうまく逃れてがんに向かうものがある。<ref name = selig>{{cite journal | author = Seliger B |title=Strategies of tumor immune evasion |journal=BioDrugs |volume=19 |issue=6 |pages=347--54 |year=2005 |pmid=16392887 |doi=10.2165/00063030-200519060-00002 }}</ref> 腫瘍細胞はしばしば表面にMHCクラスⅠ分子を発現する数が少ないので、キラーT細胞による検出を免れる。<ref name = seliger/> また腫瘍細胞の中には免疫応答を阻害する産物を放出するものがあり、例えばサイトカインTGF-βを分泌するとマクロファージやリンパ球の活性が抑制される。<ref>{{cite journal | author = Frumento G, Piazza T, Di Carlo E, Ferrini S |title=Targeting tumor-related immunosuppression for cancer immunotherapy |journal=Endocr Metab Immune Disord Drug Targets |volume=6 |issue=3 |pages=233--7 |year=2006 |pmid= 17017974 |doi=10.2174/187153006778250019}}</ref> 加えて腫瘍細胞に対し免疫寛容が発達し免疫系が腫瘍細胞をもはや攻撃しないようにさせる場合もある。<ref name = selig/> |
|||
パラメータドックス的だが、腫瘍細胞がマクロファージをおびき寄せるサイトカインを放出し、マクロファージはその後腫瘍細胞が成長するようなサイトカインと増殖因子を産生するような場合、マクロファージは腫瘍の増殖を促進できる。<ref>{{cite journal | last = Stix | first = Gary |title=A Malignant Flame | journal =Scientific American |pages=60--67 | date =July 2007 |url=http://podcast.sciam.com/daily/pdf/sa_d_podcast_070619.pdf | format = [[PDF]] | accessdate = 2007-01-01}}</ref> 加えて腫瘍細胞における低酸素状態とマクロファージ産生のサイトカインの組合せは腫瘍細胞が転移をブロックするタンパク質を産生するのを減らし、がん細胞の広がりを助けることになる。 |
|||
== 生理学的制御 == |
|||
ホルモンは免疫調節物質として働き、免疫系の感受性を変えることができる場合がある。例えば女性の性ホルモンは適応免疫応答に対しても<ref>{{cite book | last = Wira | first = CR | coauthors = Crane-Godreau M, Grant K |year=2004 | chapter = Endocrine regulation of the mucosal immune system in the female reproductive tract |title=Mucosal Immunology | editor = In: Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.) | publisher = Elsevier | location = San Francisco | id = ISBN 0124915434}}</ref> 自然免疫応答に対しても<ref>{{cite journal| last = Lang | first = TJ |year=2004 |title=Estrogen as an immunomodulator |journal=Clin Immunol |volume=113 |pages=224–230 |pmid=15507385 |doi=10.1016/j.clim.2004.05.011}}<br />{{cite journal | last = Moriyama | first = A | coauthors = Shimoya K, Ogata I ''et al.'' |year=1999 |title=Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle |journal=Molecular Human Reproduction |volume=5 |pages=656–661 |pmid=10381821 |url=http://molehr.oxfordjournals.org/cgi/content/full/5/7/656 |doi=10.1093/molehr/5.7.656}}<br />{{cite journal | last = Cutolo |first= M |coauthors= Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH|year=2004 |title=Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity |journal=Lupus |volume=13 |pages=635–638 |pmid=15485092 |doi=10.1191/0961203304lu1094oa}}<br />{{cite journal | last = King | first = AE | coauthors = Critchley HOD, Kelly RW |year=2000 |title=Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial role |journal=Molecular Human Reproduction |volume=6 |pages=191–196 |pmid=10655462 |url=http://molehr.oxfordjournals.org/cgi/content/full/6/2/191 |doi=10.1093/molehr/6.2.191}}</ref> 免疫賦活活性をもっていることが知られている。全身性エリテマトーデスのような自己免疫病は女性を選択的に襲うが、発症の時期はしばしば思春期であるという時期の一致がある。対照的にテストステロンのような男性ホルモンには免疫抑制力があるようだ。<ref>{{cite journal | last = Fimmel | fist = S | coauthors = Zouboulis CC |year=2005 |title=Influence of physiological androgen levels on wound healing and immune status in men |journal=Aging Male |volume=8 |pages=166–174 |pmid=16390741 |doi=10.1080/13685530500233847}}</ref> 他のホルモンにも免疫系を制御していると思われるものがあり、中でも有名なのがプロラクチン、成長ホルモン、ビタミンDである。<ref>{{cite journal | last = Dorshkind | first = K | coauthors = Horseman ND |year=2000 |title=The Roles of Prolactin, Growth Hormone, Insulin-Like Growth Factor-I, and Thyroid Hormones in Lymphocyte Development and Function: Insights from Genetic Models of Hormones and Hormone Receptor Deficiency | url=http://edrv.endojournals.org/cgi/content/full/21/3/292?maxtoshow=&HITS=10&hits=10&RESULTFORMAT=&author1=Dorshkind%2C+K%3B+Horseman+ND+&searchid=1&FIRSTINDEX=0&sortspec=relevance&resourcetype=HWCIT|journal=Endocrine Reviews |volume=21 |pages=292–312|pmid=10857555 |doi=10.1210/er.21.3.292}}</ref><ref>{{cite journal | last =Nagpal | first = Sunil |coauthors = Songqing Naand and Radhakrishnan Rathnachalam |year=2005|title=Noncalcemic Actions of Vitamin D Receptor Ligands | url= http://edrv.endojournals.org/cgi/content/full/26/5/662 |journal=Endocrine Reviews |volume=26| issue= 5|pages=662–687|pmid=15798098|doi=10.1210/er.2004-0002}}.</ref> ホルモンレベルが年とともに減少を続けると、特に年老いた人々にとって免疫応答が減弱する原因となる。<ref>{{cite journal | last = Hertoghe | first = T |year=2005 |title=The “multiple hormone deficiency” theory of aging: Is human senescence caused mainly by multiple hormone deficiencies? |journal=Annals of the New York Academy of Science |volume=1051 |pages=448–465|pmid=16399912 |doi=10.1196/annals.1322.035}}</ref> 反対にホルモンの中には免疫系の制御を受けるものがあり、目立つものとして、甲状腺ホルモンがあり、免疫系の制御を受ける。<ref>{{cite journal | last = Klein | first = JR |year=2006 |title=The immune system as a regulator of thyroid hormone activity |journal=Exp Biol Med |volume=231 |pages=229–236|pmid=16514168}}</ref> |
|||
免疫系は睡眠や休息によって増強され<ref>{{cite journal | last = Lange | first = T | coauthors = Perras B, Fehm HL, Born J |year=2003 |title=Sleep Enhances the Human Antibody response to Hepatitis A Vaccination | url= http://www.psychosomaticmedicine.org/cgi/content/full/65/5/831 |journal = Psychosomatic Medicine |volume=65 |pages=831–835|pmid=14508028 |doi=10.1097/01.PSY.0000091382.61178.F1}}</ref> ストレスによって損なわれる。<ref>{{cite journal | last = Khansari | first = DN | coauthors = Murgo AJ, Faith RE |year=1990 |title=Effects of stress on the immune system |journal=Immunology Today |volume=11 |pages=170–175 |pmid=2186751 |doi=10.1016/0167-5699(90)90069-L}}</ref> |
|||
ダイエットは免疫系に影響することがある。例えば新鮮な果物、野菜、ある種の脂肪酸の豊富な食物は健康な免疫系を維持促進する。<ref>{{cite journal | last = Pond | first = CM |year=2005 |title=Adipose tissue and the immune system |journal=Prostaglandins, Leukotrienes, and Essential Fatty Acids |volume=73 |pages=17--30|pmid= 15946832 |doi=10.1016/j.plefa.2005.04.005}}</ref> 同じように胎児の低栄養状態は免疫系に生涯続く損傷を与えうる。<ref>{{cite journal | last = Langley-Evans | first = SC | coauthors = Carrington LJ |year=2006 |title=Diet and the developing immune system |journal=Lupus |volume=15 |pages=746–752 |pmid=17153845 |doi=10.1177/0961203306070001}}</ref> 伝統的な医学ではハーブの中に免疫系を刺激するものがあると信じられている。このようなハーブには、例えばエキナシア、甘草、距骨(玉縁)、サルビア、ニンニク、アメリカ・ニワトコの実、シイタケ、リンザイキノコ、ヒソップ、があり、さらにハチミツがある。研究によると、作用の仕方は複雑で特徴付けは困難にしても、そのようなハーブは実際免疫系を刺激することが示唆されている。<ref>{{cite journal | last = Spelman | first = K | coauthors = Burns J, Nichols D, Winters N, Ottersberg S, Tenborg M |year=2006 |title=Modulation of cytokine expression by traditional medicines: a review of herbal immunomodulators |journal=Alternative Medicine reviews |pages=128–150 |pmid=16813462 |volume=11}}<br />{{cite journal | last = Brush | first = J | coauthors = Mendenhall E, Guggenheim A, Chan T, Connelly E, Soumyanth A, Buresh R, Barrett R, Zwickey H |year=2006 |title=The effect of Echinacea purpurea, Astragalus membranaceus and Glycyrrhiza glabra on CD69 expression and immune cell activation in humans |journal=Phytotherapy Research |volume=20 |pages=687–695 |pmid=16807880 |doi=10.1002/ptr.1938}}</ref> |
|||
== 医学における操作 == |
|||
[[Image:Dexamethasone-2D-skeletal.png|thumb|right|200px|[[免疫抑制薬]][[デキサメタゾン]]]] |
|||
免疫応答は、自己免疫、アレルギー、移植拒絶反応の結果起こる望まれない応答を抑制するよう、また、免疫系を大体逃れている病原体に対する防御反応を刺激するよう、操作しうる(ワクチン接種参照)。免疫抑制薬は自己免疫病や過剰な組織破壊が起こっている炎症の制御に、また器官移植後の移植拒絶を妨げるために使用される。<ref name= Janeway6/><ref name= Taylor>{{cite journal | author = Taylor A, Watson C, Bradley J |title=Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy |journal=Crit Rev Oncol Hematol |volume=56 |issue=1 |pages=23--46 |year=2005 |pmid=16039869 |doi=10.1016/j.critrevonc.2005.03.012}}</ref> |
|||
抗炎症薬はしばしば炎症の影響を制御するのに用いられる。糖質コルチコイドはこれらの薬品の中で最も強力なものである。しかしこれらの薬品は多くの予想外の副作用をもちうる(例えば、中心性肥満、高血糖症、骨粗鬆症)。使用は厳重にコントロールしなければならない。<ref>{{cite journal | author = Barnes P |title=Corticosteroids: the drugs to beat |journal=Eur J Pharmacol |volume=533 |issue=1--3 |pages=2--14 |year=2006 |pmid=16436275 |doi=10.1016/j.ejphar.2005.12.052}}</ref> したがって、抗炎症薬は少量にしてメトトレキセートやアザチオプリンのような細胞傷害性あるいは免疫抑制薬との組合せで用いることがしばしば行われる。細胞傷害性の薬品は活性化T細胞のような分裂中の細胞を殺すような免疫応答を阻害する。しかし殺滅作用は区別できないから定常的に分裂している細胞とそれらの器官は影響を受け、これが毒性をもった副作用をもたらす。<ref name= Taylor/> シクロスポリンのような免疫抑制薬はシグナル伝達系を阻害することによってT細胞がシグナルに正しく反応するのを阻害する。<ref>{{cite journal | author = Masri M |title=The mosaic of immunosuppressive drugs |journal=Mol Immunol |volume=39 |issue=17--18 |pages=1073--7 |year=2003 |pmid=12835079 |doi=10.1016/S0161-5890(03)00075-0}}</ref> |
|||
大きな薬品(>500Da)は、特に繰り返し何度も投与されたり、投与量が大きいと、免疫応答を中和する場合がある。大きなペプチドおよびタンパク質(典型的には6,000Da以上)に基づいた薬品の効果には限界がある。薬品自身には免疫原性はなく、免疫原性のある物質と共投与される場合がある。このようなことはタキソールの場合時々見かける。ペプチドとタンパク質の免疫原性を予想するのにコンピュータによる方法が開発されて来ており特に治療用の抗体のデザイン、ウイルスのコート粒子に起こりそうな毒性突然変異を評価したり、ペプチドベースでの薬品処理の検証に有用である。初期のテクニックでは主にエピトープ域では親水性のアミノ酸が疎水性のアミノ酸より過剰に発現されているという観察に頼っていたが、<ref name="Welling">{{cite journal|author = Welling GW, Wiejer WJ, van der Zee R, Welling-Werster S. |date = 1985 |title= Prediction of sequential antigenic regions in proteins|journal=J Mol Recognit|volume=88|issue=2|pages=215--8|pmid=2411595}}</ref> より最近の研究成果では、通常よく研究されたウイルスタンパク質に基づいてコンピュータはそれを学習材料として、知られたエピトープのデータベースに関しコンピュータが学習したテクニックに頼っている。<ref name="Sollner">{{cite journal|author = Sollner J, Mayer B. | date = 2006 |title=Machine learning approaches for prediction of linear B-cell epitopes on proteins | volume=19 |issue=3 |pages=200--8 |pmid=16598694 |doi=10.1002/jmr.771 |journal=Journal of Molecular Recognition}}</ref> 公開されてアクセスできるデータベースが、B細胞によって認識されるということが知られているエピトープのカタログ化を行うために確立されている。<ref name="Saha">{{cite journal|author=Saha S, Bhasin M, Raghava GP.|date=2005|title=Bcipep: a database of B-cell epitopes|journal=BMC Bioinformatics |volume=6 |issue=1 |pages=79 |pmid=15921533|doi=10.1186/1471-2105-6-79 }}</ref> 免疫原性のバイオインフォーマッティクスに基づいた研究分野は新たに誕生したもので免疫インフォーマティックスと言及される。<ref name="Flower">{{cite journal|author=Flower DR, Doytchinova IA.|date=2002|title=Immunoinformatics and the prediction of immunogenicity|journal=Appl Bioinformatics |volume=1 |issue=4 |pages=167--76 |pmid=15130835}}</ref> |
|||
== 病原体の操作 == |
|||
病原体の成功は宿主の免疫応答から逃れる能力に依存している。したがって病原体は宿主にうまく感染できるような方法を免疫を媒介にした破壊を免れつつ、いくつか発達させてきた。<ref name=Finlay>{{cite journal | author = Finlay B, McFadden G |title=Anti-immunology: evasion of the host immune system by bacterial and viral pathogens |journal=Cell |volume=124 |issue=4 |pages=767--82 |year=2006 |pmid=16497587 |doi=10.1016/j.cell.2006.01.034}}</ref> 細菌はしばしば物理的障壁についてはそれを分泌酵素で消化することによって切り抜ける。例えばⅡ型分泌系の利用などである。<ref>{{cite journal | author = Cianciotto NP.|title=Type II secretion: a protein secretion system for all seasons |journal=Trends Microbiol. |volume=13 |issue=12 |pages=581--8 |year=2005 |pmid=16216510|doi=10.1016/j.tim.2005.09.005}}</ref> 別の方法としてはⅢ型分泌系の利用があり、宿主細胞に穴を開ける管を挿入する。直接この管を通じて病原体から宿主へタンパク質を移動させる。管を通って輸送されるタンパク質はしばしば宿主防御を停止するのに用いられる。<ref>{{cite journal | author = Winstanley C, Hart CA|title=Type III secretion systems and pathogenicity islands |journal=J Med Microbiol. |volume=50 |issue=2 |pages=116--26 |year=2001 |pmid=11211218}}</ref> |
|||
いくつかの病原体が自然免疫系から免れるのに用いている回避戦略は、細胞内複製である(細胞内病原性とも呼ばれる)。この場合病原体は生活史の大部分を宿主細胞内で過ごす。そこでは、免疫細胞、抗体、それに補体に直接接触することはなくそれらから保護される。細胞内病原体の例としてはウイルス、食中毒細菌のサルモネラ菌、真核生物の寄生虫であるマラリアを起こすもの(''Plasmodium falciparum'')やリーシュマニア症を起こすもの(''Leishmania'' spp.)などである。結核菌(''Mycobacterium tuberculosis'')のような他の細菌は補体による溶解を阻止する保護カプセル中に生存する。<ref>{{cite journal | author = Finlay B, Falkow S |title=Common themes in microbial pathogenicity revisited | url=http://mmbr.asm.org/cgi/reprint/61/2/136.pdf |journal=Microbiol Mol Biol Rev |volume=61 |issue=2 |pages=136--69 |year=1997 |pmid=9184008}}</ref> 多くの病原体が宿主の免疫応答を弱め方向を間違うような化学物を分泌する。<ref name=Finlay/> 細菌の中には免疫系の細胞やタンパク質から守るために生物的フィルムを形成するものがある。そのような生物的フィルムは多くの感染成功例に見られ、例えば嚢胞性線維症が特徴の慢性緑膿菌感染やバークホルデリア・セノセパシア感染がある。<ref>{{cite journal | author = Kobayashi H |title=Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections |journal=Treat Respir Med |volume=4 |issue=4 |pages=241--53 |year=2005 |pmid=16086598 | doi = 10.2165/00151829-200504040-00003}}</ref> ほかに抗体に結合する表面タンパク質を発現して抗体の効力を落とす細菌がある。この例には連鎖球菌(Gタンパク質)、黄色ブドウ球菌(Aタンパク質)、ペプトスプレプトコッカス・マグナス(Lタンパク質)がある。<ref>{{cite journal | author = Housden N, Harrison S, Roberts S, Beckingham J, Graille M, Stura E, Gore M |title=Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus | url=http://www.biochemsoctrans.org/bst/031/0716/0310716.pdf |journal=Biochem Soc Trans |volume=31 |issue=Pt 3 |pages=716--8 |year=2003 |pmid=12773190 |doi=10.1042/BST0310716}}</ref> |
|||
ウイルスが適応免疫系から免れる機構はもっと込み入っている。簡単な方法は、必須なエピトープは隠しもって全く必須でないウイルス表面上のエピトープを素早く変化させることである(アミノ酸か糖あるいは両方)。例えばHIVは、宿主のターゲット細胞に侵入するのに必須なウイルス外膜のタンパク質に絶えず突然変異を起こす。抗原のこれら頻繁な変化はこれらのタンパク質を対象とするワクチンを失敗させていることを説明するだろう。抗原を宿主分子でマスクする方法は宿主細胞から逃れるのによく見られる戦略である。<ref>{{cite journal | last = Burton | first = Dennis R. | coauthors = Robyn L. Stanfield and Ian A. Wilson |title=Antibody vs. HIV in a clash of evolutionary titans | journal =Proc Natl Acad Sci U S A.|volume=102 |issue=42 |pages=14943--8 |year=2005 |pmid=16219699 |doi=10.1073/pnas.0505126102}}</ref> HIVではウイルスを覆う外膜は宿主細胞のもっとも外側の膜から作られている。このような"自己を覆い隠す"ウイルスは免疫系が"非自己"と認識するのを困難にしている。<ref>{{cite journal | author = Cantin R, Methot S, Tremblay MJ.|title=Plunder and stowaways: incorporation of cellular proteins by enveloped viruses |journal=J Virol. |volume=79 |issue=11 |pages=6577–87 |year=2005 |pmid=15890896|doi=10.1128/JVI.79.11.6577-6587.2005}}</ref> |
|||
== 免疫学の歴史 == |
|||
[[Image:Paul Ehrlich.png|right|frame|[[ポール・エールリヒ]] Paul Ehrlich]] |
|||
免疫学は免疫系の構造と機能を研究する科学である。これは医学から生まれ初期の研究は病気に対する免疫の原因についてであった。免疫に最初に言及したのは、知られる限りでは、BC430年のアテネの悪疫流行の間である。ツキジデスは、以前病気にかかって回復した人々は患者を看護しても2度罹ることはないと記した。<ref>{{cite journal | author = Retief F, Cilliers L |title=The epidemic of Athens, 430-426 BC |journal=S Afr Med J |volume=88 |issue=1 |pages=50--3 |year=1998 |pmid=9539938}}</ref> このようにして観察された獲得免疫はのちにルイ・パスツールによって探求され、ワクチン接種の開発や病気の微生物原因論の提案に結びついた。<ref>{{cite journal | author = Plotkin S |title=Vaccines: past, present and future |journal=Nat Med |volume=11 |issue=4 Suppl |pages=S5--11 |year=2005 |pmid=15812490 |doi=10.1038/nm1209}}</ref> パスツールの理論は病気の当時流布していた瘴気論のような理論に真っ向から立ち向かうもので、この証明は1891年にロバート・コッホによってなされた微生物が感染症の原因であることの証明まで待たねばならなかったが、コッホは1905年にノーベル賞に輝いた。<ref>[http://nobelprize.org/nobel_prizes/medicine/laureates/1905/ The Nobel Prize in Physiology or Medicine 1905] Nobelprize.org Accessed [[January 8]] 2007.</ref> 1901年のウォールター・リードによる、黄熱病ウイルス発見の際、ウイルスがヒト病原体として確認された。<ref>[http://www.wramc.amedd.army.mil/welcome/history/ Major Walter Reed, Medical Corps, U.S. Army] Walter Reed Army Medical Center. Accessed [[January 8]] [[2007]].</ref> |
|||
免疫学は19世紀終わりに向かって長足の進歩を遂げたが、急速な発展の中に体液性免疫および細胞性免疫の研究<ref name= Metch> |
|||
{{cite book| last =Metchnikoff | first = Elie | authorlink =Elie Metchnikoff | coauthors = Translated by F.G. Binnie.| title =Immunity in Infective Diseases| publisher =Cambridge University Press| date =1905 |url=http://books.google.com/books?vid=OCLC03666307&id=ywKp9YhK5t0C&printsec=titlepage&vq=Ehrlich&dq=history+of+humoral+immunity | format =Full Text Version: Google Books| doi = | id = ISBN 68025143}}</ref> で特に重要なのはポール・エールリヒの仕事であり、彼は抗原-抗体反応の特異性の説明に側鎖説を唱えた。体液性免疫の理解に対する貢献は、細胞性免疫研究の立役者であるエリー・メトチニコフと共同で1908年ノーベル賞受賞で認められた。<ref>[http://nobelprize.org/nobel_prizes/medicine/laureates/1908/ The Nobel Prize in Physiology or Medicine 1908] Nobelprize.org Accessed [[January 8]] [[2007]]</ref> |
|||
== 引用文献 == |
|||
{{reflist}} |
|||
[[en:immune_system]] |
|||
2008年9月4日 (木) 14:23時点における版
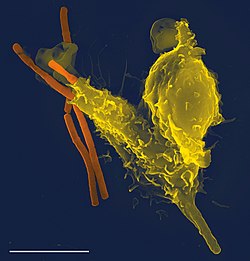
免疫系(めんえきけい、immune system)は生体内で病原体やがん細胞を認識して殺滅することにより生体を病気から保護する多数の機構が集積した一大機構である。この機構はウイルスから寄生虫まで広い範囲の病原体を感知し、作用が正しく行われるために、生体自身の健常細胞や組織と区別しなければならない。この認識機構は、病原体は宿主にうまく感染できるように適応し新たな進化も遂げているので、複雑である。
この困難な課題を克服して生き延びるために、病原体を認識して中和する機構が一つならず進化した。細菌のような簡単な単細胞生物でもウイルス感染を防御する酵素系をもっている。その他の基本的な免疫機構は古代の真核生物において進化し現代の子孫である植物、魚類、ハ虫類、昆虫に残存している。これらの機構はディフェンシンと呼ばれる抗微生物ペプチドが関与する機構であり、貪食機構であり、[1] 補体系である。ヒトのような脊椎動物はもっと複雑な防御機構を進化させた。脊椎動物の免疫系は多数のタイプのタンパク質、細胞、器官、組織からなり、それらは互いに入り組んだダイナミックなネットワークで相互作用している。このようないっそう複雑な免疫応答の中で、ヒトの免疫系は特定の病原体に対してより効果的に認識できるよう長い間に適応してきた。この適応プロセスは適応免疫あるいは獲得免疫(あるいは後天性免疫)と呼ばれ、免疫記憶を作り出す。特定の病原体への初回応答から作られた免疫記憶は、同じ特定の病原体への2回目の遭遇に対し増強された応答をもたらす。獲得免疫のこのプロセスがワクチン接種の基礎である。
免疫系が異常を起こすと病気になる場合がある。免疫系の活動性が正常より低いと、免疫不全病が起こり感染の繰り返しや生命を脅かす感染が起こされる。免疫不全病は、重症複合免疫不全症のような遺伝病に結果であったり、レトロウイルスによって起こされる後天性免疫不全症候群(AIDS)のような医薬品や感染が原因であったりする。反対に自己免疫病は、正常組織に対しあたかも外来生物に対するように攻撃を加える、免疫系の活性亢進からもたらされる。ありふれた自己免疫病として、関節リウマチ、Ⅰ型糖尿病、紅斑性狼瘡がある。免疫学は免疫系のあらゆる領域の研究をカバーし、ヒトの健康や病気に深く関係している。この分野での研究をさらに推し進めることは健康増進および病気の治療において重大な役割を果たすことが期待できる。
重層的防御体制
免疫系は、感染から生体を、特異性を高めながら重層的な防御体制で守る。最も簡単なのは、物理的な障壁で、細菌やウイルスが生体に侵入するのを防ぐことである。病原体がこの障壁を破ったとき、即座に自然免疫(先天性免疫とも呼ばれる)が発動し非特異的な応答を行う。自然免疫はあらゆる植物および動物に認められる。[2] しかし病原体が自然免疫もうまく逃れたなら脊椎動物は第3階層の防御反応を繰り出す。これが適応免疫であり、自然免疫によって発動される。ここで免疫系は感染を受ける間、応答を病原体への認識が改善されるよう適応する。この改善された応答は、次いで、病原体が排除された後も免疫記憶として残り、この病原体が侵入するたびにより早く強力な攻撃が加えられるようにする。[3]
| 項目 | 自然免疫系 | 適応免疫系 |
|---|---|---|
| 応答の特異性 | なし | 病原体あるいは抗原特異的 |
| 接触後最大応答までの時間 | 短い(即座) | 長い |
| 関与する成分 | 細胞性および体液性 | 細胞性および体液性 |
| 免疫記憶 | なし | あり |
| 生物界での分布 | ほとんど全ての生物 | 顎をもった脊椎動物 |
自然免疫も適応免疫もその効果のほどは自己と非自己の分子の区別ができる能力をもった免疫系かどうかにかかっている。免疫学において自己分子とは、免疫系によって外来物質と区別できるような自己の身体要素のことである。[4] 反対に非自己分子とは、免疫系によって外来物質と区別される外来分子のことである。非自己分子の一つのクラスは、抗原(antigen; これはantibody generatorの短縮語である)と呼ばれ、特異的な免疫受容体に結合し、免疫応答を誘発する物質と定義される。[5]
体表面障壁
生体を感染から守る障壁にはいくつかあって、機械的なもの、生化学的なもの、および生物学的なものがある。葉に見られるワックス性クチクラ、昆虫の外骨格、産み落とされた卵の殻や膜、そして皮膚。これらは機械的障壁の例であって、感染に対する防御ラインの第一線にある。[5] しかし生体は外界に対して完全に密閉されることはできないのだから、肺、腸、性尿器路など、外界に対して開口された部分を守るのには他の系を作動させる。肺では咳やくしゃみは病原体や呼吸管の他の刺激物質を機械的に排除する。涙や尿を流す行動も病原体を機械的に追い出すし、呼吸管や胃腸管の分泌粘液には微生物を捕らえ絡み取る働きがある。[6]
生化学的障壁も感染防御に働く。皮膚や呼吸管はβ-ディフェンシンのような抗微生物ペプチドを分泌する。[7] 唾液、涙、母乳中のリソゾームやホスホリパーゼA2等の酵素も抗細菌物質である。[8][9] 膣分泌液は初経後のわずかにでも酸性に傾いたとき化学的障壁として働くし、精液は病原体殺滅性のあるデフェンシンや亜鉛を含む。[10][11] 胃には胃酸およびタンパク質分解酵素があって、摂取された病原体に対して強力な化学的防御の働きがある。
生殖尿管や胃腸管では共生細菌叢が病原菌と食物や繁殖場所をめぐって競争して生物学的障壁として働いている。この場合、pHや利用できるイオンのような環境を変えることもある。[12] このことは病原体が病気を起こすに至る十分な数まで増殖できる可能性を減らす。しかし大部分の抗生物質は細菌に対し非特異的に作用するし、カビには効かないので抗生物質を経口的に飲むとカビを異常に増殖させ、膣カンジダ症(真菌感染)のような症状を引き起こす。[13] ヨーグルトに通常含まれている乳酸菌のような純粋カルチャーによって良性細菌叢を再導入することは、子供たちの腸管感染での微生物集団のバランスを健康なものに保つのを助ける働きがあるという証拠が出されている。これは細菌性胃腸炎、炎症性腸疾患、尿路感染症、術後感染の研究の予備的データに希望を与えている。[14][15][16]
自然免疫
微生物や毒性物質が生体内にうまく侵入できると、それらは生体細胞と接触し、自然免疫が発動する。この自然免疫応答は普通生体が微生物を構造パターン認識受容体で感知するときに発動する。この構造パターンは広い範囲の微生物グループの間で保存されている。[17] あるいは細胞は障害を受けると警戒シグナルを出す。それらの全てではないが多くは病原体を認識する同じ受容体によって感知される。[18] Innate immune defenses are non-specific, meaning these systems respond to pathogens in a generic way.[5] 自然免疫系防御は非特異的である。つまり病原体に対して包括的な応答を行う。[5] この系は病原体に対し、長期間に渡って効く免疫はもたない。自然免疫系は大部分の生物にとって宿主防御の主要な系である。[2]
体液性および化学的障壁
炎症
炎症は免疫系が感染に対し最初に起こす応答の一つである。[19] 炎症の徴候は発赤と腫れで、組織に流入する血液の増加によって起こされる。炎症は傷害や感染を受けた細胞が分泌するエイコサノイドとサイトカインによって生じる。エイコサノイドにはプロスタグランジンが含まれ、この物質は炎症に関係した場合、発熱と血管拡張を起こす。また同じくエイコサノイドに含まれるロイコトリエンはある種の白血球(リンパ球)に作用する。[20][21] 一般的なサイトカインとしては白血球間の情報伝達に関与したインタロイキン、走化性を増強するケモカイン、宿主細胞のタンパク質合成を停止させるようなウイルスに対して、抗ウイルス活性をもったインターフェロンなどがある。[22] 増殖因子や細胞毒性因子も分泌される場合がある。これらのサイトカインや他の化学物質は免疫細胞を感染部位に動員し、病原体を排除してから損傷を受けたいかなる組織も治癒が促進されるように作用する。[23]
補体系
補体系は外来細胞の表面に攻撃を加える生化学的カスケードである。20以上のタンパク質が関与し、抗体による病原体殺滅を補 強する能力をもつ、という意味で名づけられた。補体は自然免疫応答において主要な体液性要素をなす。[24][25] 補体系をもつ種は数多くあり、哺乳類以外にも、植物、魚類、それに無脊椎動物の数種がある。[26]
ヒトではこの応答はこれら微生物に付着した抗体に補体が結合することにより、あるいは微生物の表面の炭水化物に補体タンパク質が結合することにより活性化される。この認識シグナルが、速やかな殺滅応答を発動する。[27] 応答のスピードを決めるのは引き続いて起こる補体分子のタンパク質分解の活性化によって起こるシグナル増強の程度である。補体タンパク質自身もタンパク分解酵素である。補体タンパク質が微生物に付着した後、補体自身のタンパク分解酵素活性が発現し、続いて他の補体タンパク分解酵素が活性化され、これが連続して起こる。これは触媒反応カスケードを引き起こし、最初のシグナルを正のフィードバックでコントロールしながら増強するものである。[28] このカスケードはペプチドを賛成して免疫細胞を誘引し、血管の透過性を更新し、病原体の表面をオプソニン化(コート)して破壊できるようマークを付ける。補体がこうしてまとわりつくことによっても細胞膜は直接破壊され病原体は殺される。[24]
細胞障壁

白血球は独立した単細胞生物のように行動し、自然免疫系の右腕である。[5] 自然免疫系の白血球には貪食細胞(マクロファージ、好中球、および樹状細胞)、マスト細胞(肥満細胞)、好酸球、好塩基球、NK細胞が含まれる。これらの細胞はより大きな病原体に対してもそれを認識し排除するが、その際、接触して攻撃するか、あるいは微生物を呑み込んで殺滅する。[26] これら自然免疫系細胞も、適応免疫系の活性化に重要なメディエータである。[3]
貪食機能は細胞性自然免疫で重要な役割をもっており、病原体や粒状物を呑み込み食す貪食細胞と呼ばれる細胞によって行われる。貪食細胞は一般に病原体を捜して体内をパトロールするが、サイトカインによって特定の部位に誘導される。[5] 病原体は一旦貪食細胞に呑み込まれるとファーゴソームと呼ばれる細胞内小胞によって捕らえられ、続いてリソソームと呼ばれる今一つ別の小胞と融合してファーゴリソソームを形成する。病原体は消化酵素によって、あるいは呼吸バーストに続くフリーラジカルのファーゴリソソームへの放出によって殺滅される。[29][30] 貪食機能は栄養素獲得のために進化したが、貪食細胞ではこの役割が拡張されて病原体の貪食を含んだ防御機構として働く。[31] 貪食機能は、貪食細胞が脊椎動物にも無脊椎動物にも存在することから、おそらく宿主防御の最も古い形を示したものであろう。[32]
好中球とマクロファージは侵入病原体を捜して体内全体を移動している貪食細胞である。[33] 好中球は通常血流中に存在し、貪食細胞中最も豊富である。通常全循環白血球の50%~60%を占める。[34] 特に細菌感染の結果生じる炎症急性期には好中球は走化性というプロセスによって炎症部位に移動する。通常感染が生じた場面で最初に到着する細胞である。マクロファージは多才な細胞で、組織中に存在し、酵素、補体タンパク質、それにインターロイキン-1のような制御因子など広範囲にわたる化学物質を産生する。[35] マクロファージは死体・ゴミあさりの(スカベンジャー)細胞としても働き、体内の役に立たなくなった細胞、およびその他の崩壊沈着物の除去および適応免疫系を活性化する抗原提示細胞として働く。[3]
樹状細胞(DC; dendritic cell)は外界に接する組織中の貪食細胞である。したがってこの細胞は主に皮膚、鼻、肺、胃、および腸に存在する。[36] この細胞の名称は神経細胞の樹状突起(dendrite)に似ていることから付けられた。両方とも樹状突起を多数もっているが、樹状細胞は神経系につながるすべは全くもたないのだが。樹状細胞はT細胞に抗原を提示するので、体内の組織と自然免疫系および適応免疫系への橋渡しをする役割がある。T細胞は適応免疫系の鍵となる細胞タイプの一つである。[36]
マスト細胞(肥満細胞)は結合組織および粘性膜に存在し、炎症応答を制御する。[37] この細胞は最も多くはアレルギーとアナフィラキシーに関与する。[34] 好塩基球と好酸球は好中球の関連細胞で、寄生虫に対する防御の際に化学メディエータを分泌し、喘息のようなアレルギー反応に係わる。[38] ナチュラルキラー細胞(NK細胞)は腫瘍細胞あるいはウイルス感染症腺細胞を攻撃して破壊する。[39]
適応免疫
適応免疫系は初期の脊椎動物に進化し、より強力な免疫反応を起こし、個々の病原体が特定の型であることを示す抗原によって記憶される免疫記憶を保持する。[40] 適応免疫応答は抗原特異的であり、抗原提示と呼ばれるプロセスの間に特異的な非自己の抗原であるという認識が行われる必要がある。抗原特異性の認識によって、特定の病原体あるいは特定の病原体感染細胞に対して調整された応答の発動を可能とする。このような調整された応答を開始する能力は体内の記憶細胞によって保持される。もし病原体が1回以上生体に感染するなら、このような特定の記憶細胞が使われて即座に病原体は排除される。
リンパ球
適応免疫系の細胞は特定の型の白血球であり、リンパ球と呼ばれる。リンパ球の主要なタイプの細胞はB細胞とT細胞であり、骨髄中の造血幹細胞に由来する。[26] B細胞は体液性免疫応答に関与し、T細胞は細胞性免疫応答に関与する。
B細胞もT細胞も特異的なターゲット抗原を認識する受容体分子をもっている。T細胞は抗原(病原体の小さな断片)が加工されて自己の受容体である主要組織適合遺伝子複合体(MHC、Major Histocompatibility Complex)分子と組み合わさって提示されて初めて病原体のような非自己のターゲットを認識する。T細胞のサブタイプには主要な2つのタイプがある。キラーT細胞とヘルパーT細胞である。キラーT細胞はクラスⅠMHC分子と結合した抗原のみを認識し、ヘルパーT細胞はクラスⅡMHC分子と結合した抗原のみを認識する。抗原提示におけるこの2つの機構はT細胞2タイプの機能の違いに原因がある。3番目のマイナーなサブタイプのT細胞としてγδT細胞があり、MHC受容体に結合しない、非加工の抗原を認識する。[41]
対照的にB細胞の抗原特異的受容体はB細胞表面上の抗体分子であり、抗原加工を全く必要とせず、病原体全体を認識する。B細胞の増殖系はそれぞれ異なった抗体を発現し、B細胞の抗原受容体の完全な1セットは生体が生成可能な全ての抗体を表すものである。[26]

キラーT細胞
キラーT細胞はT細胞のサブグループであって、ウイルス(および他の病原体)に感染した細胞を殺滅する。これがなされない場合損傷を与え機能不全をもたらす。[43] B細胞で行われているように各T細胞タイプは異なる抗原を認識する。キラーT細胞はT細胞受容体がこの特定の抗原が他の細胞のMHCクラスⅠ受容体と複合体を作っているときに抗原と結合する。このMHC-抗原複合体はT細胞上のCD8と呼ばれるコレセプターの助けを得て認識される。したがってこのT細胞はこのような抗原を保持したMHCⅠ受容体を発現させている細胞を捜して、体内をくまなく移動する。活性化したT細胞がこのような細胞と接触するとT細胞はパーフォリンのようなサイトカインを放出する。パーフォリンはターゲット細胞の細胞膜に穴を開け、イオンや水分さらに毒性物質を侵入させる。グラニュライシン(タンパク分解酵素)と呼ばれるほかの毒性物質の侵入はターゲット細胞にアポトーシスを誘導する。[44] T細胞による宿主細胞の殺滅は、ウイルスの増殖を妨害する上で特に重要である。T細胞の活性化は強く制御されており、一般にきわめて強力なMHC/抗原の活性シグナルを必要とする。あるいは付加的な活性シグナルはヘルパーT細胞から供される(下記参照)。[44]
ヘルパーT細胞

ヘルパーT細胞は自然免疫系も適応免疫系も制御する。そして生体が特定の病原体に対して応答するのにどちらのタイプを用いるかを決定するのを助ける。[45][46] このT細胞は細胞毒性活性は全くもたず、感染細胞を殺滅したり、病原体を直接排除しない。代わりに他の細胞がそのような仕事をするよう方向付けて免疫系を制御する。
ヘルパーT細胞もT細胞受容体(TCR)を発現し、クラスⅡMHCと結合した抗原を認識する。MHC:抗原複合体はヘルパーT細胞のCD4コレセプターによっても認識され、T細胞活性化に作用するT細胞内の分子(例えばLck)を動員する。ヘルパーT細胞のMHC:抗原複合体との会合はキラーT細胞より弱い。このことはヘルパーT細胞の活性化にT細胞上の多くの受容体(200~300個)が結合しなければならないことを意味している。一方キラーT細胞の場合は1個のMHC:抗原分子が関与すると活性化できる。ヘルパーT細胞の活性化には抗原提示細胞とのいっそう長い相互作用をも必要とする。[47] 静止期ヘルパーT細胞が活性化されると他の多くの細胞タイプの活性が影響を受けるサイトカインが放出される。ヘルパーT細胞によってもたらされるサイトカインシグナルはマクロファージの微生物殺滅作用を増強し、キラーT細胞の活性も増強する。[5] 加えてヘルパーT細胞の活性化はT細胞表面の分子CD40(CD154とも呼ばれる)などの発現を増強制御する。この分子は抗体産生B細胞を活性化するのに必要な代表的な付加的刺激シグナルとして働く。[48]
γδT細胞
γδT細胞はCD4+およびCD8+(αβ)T細胞とは対照的に別のT細胞受容体(TCR)をもち、ヘルパーT細胞、細胞傷害性T細胞、およびNK細胞と同じ性質を共有する。γδT細胞から応答を得る条件は完全には解明されていない。他のなじみのない変異型TCRをもったT細胞サブセット、例えばCD1d-限定ナチュラルキラーT細胞などと同様に、自然免疫と適応免疫の間を広くまたいでいる。[49] 一方でγδT細胞は、この細胞はTCR遺伝子を再編成して受容体の多様性を生じること、そして記憶表現型も発達させることができることから、適応免疫の要素である。他方様々なサブセットは、制限されたTCRあるいはNK受容体が受容体のパターン認識に用いられることがあるため、自然免疫系の一部分をなす。例えばきわめて多数のヒトVγ9/Vδ2 T細胞は微生物によって産生される共通の分子に対して数時間以内に応答する。さらに高度に制限されたVδ1+ T細胞は上皮細胞が受けるストレスに応答するようだ。[50]

Bリンパ球と抗体
1個のB細胞は表面上の抗体が特定の外来抗原に結合すると病原体を認識することになる。[51] この抗原/抗体複合体はB細胞によって取り込まれタンパク質分解プロセスによってペプチドにされる。B細胞は次にこれら抗原ペプチドをMHCⅡ分子上に提示する。MHCと抗原の複合体は対応するヘルパーT細胞を誘導し、B細胞を活性化するリンフォカインを放出する。[52] B細胞が活性化されて増殖のための分裂を始めるとその子孫(形質細胞)はこの抗原を認識する抗体コピーを何百万分子も分泌する。これらの抗体は血漿およびリンパ球に入って循環しこの抗原を発現している病原体に結合し、補体系の活性化あるいは貪食細胞による取り込みと破壊が起きるようマークを付ける。抗体は侵入病原体に対し、細菌の毒素に結合したりウイルスや細菌が細胞に感染する際に利用する受容体に妨害作用を及ぼして、直接中和することもできる。[53]
代替的適応免疫系
適応免疫の古典的な分子(例えば抗体やT細胞受容体)は顎をもった脊椎動物のみに存在するにも拘わらず、ヤツメウナギやメクラウナギのような原始的な無顎脊椎動物には独特なリンパ球由来の分子が発見されている。これらの動物には変異性リンパ球受容体(VLRs)と呼ばれる大きな一群の分子が備わり、顎をもった脊椎動物の抗原受容体のようにごくわずかな数(1つか2つ)の遺伝子のみから産生される。これらの分子は抗体と同じやり方で病原体の抗原に抗体と同じ程度の特異性をもって結合すると信じられている。[54]
免疫記憶
B細胞とT細胞が活性化されて複製を始めるとそれらの子孫細胞の中には長期間体内に残存する記憶細胞になるものがあるだろう。動物の生涯にわたってこれらの記憶細胞は各々の特異的な病原体に出合った記憶を保持し、病原体が再び感知されると強力な応答を発動できる。これは、個体の生涯にわたって病原体による感染に適応して起こり、免疫系が将来の接触に対して準備するものであるから、「適応」であると言える。免疫記憶は短期間の受動的な記憶の形か長期間にわたる能動的な記憶の形かのいずれかで成立しうる。
受動的な記憶
新生児はあらかじめ微生物に接触することはなく特に感染を受けやすい。そこで母親からいくつかの階層からなる受動防御が提供される。妊娠中抗体の特別の型IgGが胎盤を経由して直接母親から胎児に輸送される。したがってヒト新生児は誕生時すでに高レベルの母親と同じ抗原特異性の幅を持った抗体をもっている。[55] 母乳も抗体をもっており赤ん坊の胃に移動し、新生児が自分自身の抗体を合成できるまで、細菌感染を防御する。[56] これは受動免疫であって、胎児は実際記憶細胞あるいは抗体を作らずそれらを母親から借用するだけであるから、この受動免疫は普通短期間のもので、数日から数カ月しか続かない。医学では、防御的な受動免疫が、ある個人から他人へ抗体リッチな血清を人工的に移すことでも行いうる。[57]

能動的な記憶と免疫処置
長期的な能動的な記憶は感染後BおよびT細胞の活性化によって獲得される。能動免疫は人工的にもワクチン接種によって成立させ得る。ワクチン接種(あるいは免疫処置と呼ばれる)の原理は病原体の抗原を導入し免疫系を刺激してその特定の病原体に対する特異的免疫を発達させその病原体由来の病気を起こさないようにすることである。[5] この意図的な免疫応答の誘導は免疫系が自然に作り出している特異性を利用していること、そうして免疫を誘導できるということによって成功している。ヒト集団の主要な死因の一つに感染症があることからワクチン処置は人類が発展させた免疫系の操作の中で最も効果のあるものである。[58][26]
大部分のウイルスワクチンは生きた弱毒化したウイルスをもとにしているが多くの細菌ワクチンは有害作用のない毒物質の成分など細菌の構成要素の非細胞成分をもとにしている。[5] 多くの非細胞成分由来の抗原によるワクチンはあまり適応免疫応答を起こさないため、大部分の細菌ワクチンは、自然免疫の抗原提示細胞を活性化し免疫原性を最大にするアジュバンドを添加して提供される。[59]
ヒトの免疫異常
免疫系は、特異性、誘導性、および適応性を取り込んできわめて効果的な構造をもつに至っている。しかし宿主防御に失敗することがあり、これは3つの大まかなカテゴリーに分けられる。免疫不全、自己免疫、過敏症、である。
免疫不全
免疫不全は免疫系の1つないしそれ以上の要素が機能しない場合に起きる。免疫系が病原体に対して応答する能力は、若くても年を取っても減退する。免疫応答は50才位から免疫老化のために衰え始める。[60][61] 先進国では肥満、アルコール依存症、薬物使用は免疫機能を弱める共通の原因である。[61] しかし開発途上国では栄養不良が免疫不全の最も多く見られる原因である。[61] 十分なタンパク質を取らないダイエットは細胞性免疫や補体活性、貪食細胞機能、IgA抗体濃度、サイトカイン産生を損なう。栄養素であるイオン、銅、亜鉛、セレン、ビタミンA、C、E、B6、葉酸(ビタミンB9)が1つでも欠乏したら免疫応答は減退する。[61] 加えて若いときに胸腺を遺伝的突然変異の原因か手術による摘出で失うと、重症の免疫不全を起こし、感染性が非常に高くなる。[62]
免疫不全は遺伝でも後天的でも生じうる。[5] 慢性肉芽腫症では、貪食細胞の病原体破壊力が弱いということがあるが、遺伝性または先天性の免疫不全の例であるAIDSやいくつかのがんの型は、後天的な免疫不全を起こす。[63][64]
自己免疫
免疫応答の亢進は特に自己免疫病のような免疫不全の一方の極端をなす。ここでは免疫系は、自己と非自己を的確に区別できないで、自己の身体部分を攻撃する。普通の状態では多くのT細胞を抗体は自己のペプチドと反応する。[65] 特別な細胞(胸腺および骨髄に潜む)の機能の1つに若いリンパ球に体内で産生されている自己抗原を提示し、自己抗原と認識した細胞を排除して自己免疫を防いでいる。[51]
過敏症
過敏症は自己の組織に損傷を与える免疫応答である。これは機構と過敏反応が起きる時間経過に基づいて、4クラスに分けられる。Ⅰ型過敏症は即時的な反応あるいはアナフィラキシー反応で、しばしばアレルギーに付随している。症状は穏やかな不快さから死に至るまで幅広い。Ⅰ型過敏症はマスト細胞や好塩基球が分泌するIgEが原因である。[66] Ⅱ型過敏症は抗体が自己の細胞の抗原に結合してそれを破壊するようマークを付けることから起こる。これは抗体依存性(あるいは細胞傷害性)過敏症と呼ばれ、IgGやIgM抗体が原因である。[66] 免疫複合体(抗原の凝集、補体タンパク質、およびIgGとIgM抗体)が様々な組織で沈着するとⅢ型過敏症の反応が引き起こされる。[66] Ⅳ型過敏症は(細胞媒介性あるいは遅延型過敏症としても知られるが)生じるまでに普通は2~3日かかる。Ⅳ型の反応は多くの自己免疫病や感染症で見られるが、接触皮膚炎(ツタウルシ)にも見られる場合がある。これらの反応に関与しているのはT細胞、単球およびマクロファージである。[66]
他の機構
無脊椎動物はリンパ球を生み出していないし、抗体に基づいた体液性反応も生み出していないので多要素からなる適応免疫系は最初の脊椎度物に生じたと思われる。[1] しかし多くの種は脊椎度物の免疫のこれらの諸面の前駆機能として発現させている機構を活用している。免疫系は生物の機能構造としては最も簡単なものでさえあると見受けられる。細菌はバクテリオファージと呼ばれるウイルス病原体から守るために制限修飾系と呼ばれるユニークな防御機構を用いている。[67] 原核生物も獲得免疫系をもっており、過去に接触したファージのゲノム断片を保持するのにCRISPR配列を用いてRNA干渉のような形でウイルスの複製を妨害することができる。[68][69]
パターン認識受容体は病原体に付随した分子を感知するのにほとんど総ての生物によって利用されている。ディフェンシンと呼ばれる抗微生物ペプチドは全ての動物および植物に見られる自然免疫応答の進化的に保存された要素の1つである。[1] 補体系や貪食細胞も大部分の無脊椎動物で利用されている。リボヌクレアーゼとRNA干渉の反応経路は全ての真核生物で保存されていてウイルスに対する免疫応答に役割を果たしていると考えられる。[70]
動物と違い植物では貪食細胞を欠く。植物の大部分の免疫応答には植物から放出される全身的な化学的シグナルがある。[71] 植物の一部が感染を受けるとその植物は局所的な過敏性の反応を起こす。そのことによって感染部位の細胞は速やかなアポトーシスを起こし他の植物への感染の広がりを阻止する。全身獲得抵抗性(SAR; Systemic Acquired Resistance)は防御反応の1つの型で、植物全体が特定の感染性病原体に抵抗するようにする。[71] RNAサイレンシング機構はウイルス複製をブロックできるのでこの全身的応答に特に重要である。[72]
腫瘍免疫

免疫系の他の重要な役割に腫瘍を見つけて排除することがある。腫瘍による形質転換細胞は正常細胞にない抗原を発現する。免疫系にとってこれらの抗原は非自己に見え、免疫細胞は形質転換した腫瘍細胞を攻撃する。腫瘍によって発現する抗原にはいくつかのソースがある。子宮頚がんを起こすヒトパピローマウイルスのような発がん性ウイルス由来のもの。[74] [75] 他は正常細胞では低レベルにしか見られないが腫瘍細胞で高レベルで見られるような自己タンパク質である。1例としてチロシナーゼと呼ばれる酵素があり、これは高レベルに発現するとある種の皮膚細胞(例えばメラノサイト)をメラノーマと呼ばれる腫瘍細胞に転換させる。[76][77] 腫瘍抗原の3番目の可能なソースは正常細胞では細胞増殖や生存の制御に重要なタンパク質が普通に突然変異を起こしてがん誘起分子に変わる。[74][78][79]
免疫系の腫瘍に対する主な反応は異常細胞をキラーT細胞やときにヘルパーT細胞の補助を受けて破壊することである。[77][80] 腫瘍抗原はウイルス抗原と同じようにMHCクラスⅠ分子上に提示される。これによってキラーT細胞は腫瘍細胞を異常と見なす。[81] NK細胞も同じように腫瘍性の細胞を殺滅し特にMHCクラスⅠ分子が正常に比べ少なく発現されている腫瘍細胞に対して作用する。このことは腫瘍細胞では一般的な現象として見られることである。[82] 往々にして腫瘍細胞に対して抗体が産生され補体系にもそれらの細胞を破壊することが図られる。[78]
明らかに腫瘍の中には免疫系をうまく逃れてがんに向かうものがある。[83] 腫瘍細胞はしばしば表面にMHCクラスⅠ分子を発現する数が少ないので、キラーT細胞による検出を免れる。[81] また腫瘍細胞の中には免疫応答を阻害する産物を放出するものがあり、例えばサイトカインTGF-βを分泌するとマクロファージやリンパ球の活性が抑制される。[84] 加えて腫瘍細胞に対し免疫寛容が発達し免疫系が腫瘍細胞をもはや攻撃しないようにさせる場合もある。[83]
パラメータドックス的だが、腫瘍細胞がマクロファージをおびき寄せるサイトカインを放出し、マクロファージはその後腫瘍細胞が成長するようなサイトカインと増殖因子を産生するような場合、マクロファージは腫瘍の増殖を促進できる。[85] 加えて腫瘍細胞における低酸素状態とマクロファージ産生のサイトカインの組合せは腫瘍細胞が転移をブロックするタンパク質を産生するのを減らし、がん細胞の広がりを助けることになる。
生理学的制御
ホルモンは免疫調節物質として働き、免疫系の感受性を変えることができる場合がある。例えば女性の性ホルモンは適応免疫応答に対しても[86] 自然免疫応答に対しても[87] 免疫賦活活性をもっていることが知られている。全身性エリテマトーデスのような自己免疫病は女性を選択的に襲うが、発症の時期はしばしば思春期であるという時期の一致がある。対照的にテストステロンのような男性ホルモンには免疫抑制力があるようだ。[88] 他のホルモンにも免疫系を制御していると思われるものがあり、中でも有名なのがプロラクチン、成長ホルモン、ビタミンDである。[89][90] ホルモンレベルが年とともに減少を続けると、特に年老いた人々にとって免疫応答が減弱する原因となる。[91] 反対にホルモンの中には免疫系の制御を受けるものがあり、目立つものとして、甲状腺ホルモンがあり、免疫系の制御を受ける。[92]
免疫系は睡眠や休息によって増強され[93] ストレスによって損なわれる。[94]
ダイエットは免疫系に影響することがある。例えば新鮮な果物、野菜、ある種の脂肪酸の豊富な食物は健康な免疫系を維持促進する。[95] 同じように胎児の低栄養状態は免疫系に生涯続く損傷を与えうる。[96] 伝統的な医学ではハーブの中に免疫系を刺激するものがあると信じられている。このようなハーブには、例えばエキナシア、甘草、距骨(玉縁)、サルビア、ニンニク、アメリカ・ニワトコの実、シイタケ、リンザイキノコ、ヒソップ、があり、さらにハチミツがある。研究によると、作用の仕方は複雑で特徴付けは困難にしても、そのようなハーブは実際免疫系を刺激することが示唆されている。[97]
医学における操作

免疫応答は、自己免疫、アレルギー、移植拒絶反応の結果起こる望まれない応答を抑制するよう、また、免疫系を大体逃れている病原体に対する防御反応を刺激するよう、操作しうる(ワクチン接種参照)。免疫抑制薬は自己免疫病や過剰な組織破壊が起こっている炎症の制御に、また器官移植後の移植拒絶を妨げるために使用される。[26][98]
抗炎症薬はしばしば炎症の影響を制御するのに用いられる。糖質コルチコイドはこれらの薬品の中で最も強力なものである。しかしこれらの薬品は多くの予想外の副作用をもちうる(例えば、中心性肥満、高血糖症、骨粗鬆症)。使用は厳重にコントロールしなければならない。[99] したがって、抗炎症薬は少量にしてメトトレキセートやアザチオプリンのような細胞傷害性あるいは免疫抑制薬との組合せで用いることがしばしば行われる。細胞傷害性の薬品は活性化T細胞のような分裂中の細胞を殺すような免疫応答を阻害する。しかし殺滅作用は区別できないから定常的に分裂している細胞とそれらの器官は影響を受け、これが毒性をもった副作用をもたらす。[98] シクロスポリンのような免疫抑制薬はシグナル伝達系を阻害することによってT細胞がシグナルに正しく反応するのを阻害する。[100]
大きな薬品(>500Da)は、特に繰り返し何度も投与されたり、投与量が大きいと、免疫応答を中和する場合がある。大きなペプチドおよびタンパク質(典型的には6,000Da以上)に基づいた薬品の効果には限界がある。薬品自身には免疫原性はなく、免疫原性のある物質と共投与される場合がある。このようなことはタキソールの場合時々見かける。ペプチドとタンパク質の免疫原性を予想するのにコンピュータによる方法が開発されて来ており特に治療用の抗体のデザイン、ウイルスのコート粒子に起こりそうな毒性突然変異を評価したり、ペプチドベースでの薬品処理の検証に有用である。初期のテクニックでは主にエピトープ域では親水性のアミノ酸が疎水性のアミノ酸より過剰に発現されているという観察に頼っていたが、[101] より最近の研究成果では、通常よく研究されたウイルスタンパク質に基づいてコンピュータはそれを学習材料として、知られたエピトープのデータベースに関しコンピュータが学習したテクニックに頼っている。[102] 公開されてアクセスできるデータベースが、B細胞によって認識されるということが知られているエピトープのカタログ化を行うために確立されている。[103] 免疫原性のバイオインフォーマッティクスに基づいた研究分野は新たに誕生したもので免疫インフォーマティックスと言及される。[104]
病原体の操作
病原体の成功は宿主の免疫応答から逃れる能力に依存している。したがって病原体は宿主にうまく感染できるような方法を免疫を媒介にした破壊を免れつつ、いくつか発達させてきた。[105] 細菌はしばしば物理的障壁についてはそれを分泌酵素で消化することによって切り抜ける。例えばⅡ型分泌系の利用などである。[106] 別の方法としてはⅢ型分泌系の利用があり、宿主細胞に穴を開ける管を挿入する。直接この管を通じて病原体から宿主へタンパク質を移動させる。管を通って輸送されるタンパク質はしばしば宿主防御を停止するのに用いられる。[107]
いくつかの病原体が自然免疫系から免れるのに用いている回避戦略は、細胞内複製である(細胞内病原性とも呼ばれる)。この場合病原体は生活史の大部分を宿主細胞内で過ごす。そこでは、免疫細胞、抗体、それに補体に直接接触することはなくそれらから保護される。細胞内病原体の例としてはウイルス、食中毒細菌のサルモネラ菌、真核生物の寄生虫であるマラリアを起こすもの(Plasmodium falciparum)やリーシュマニア症を起こすもの(Leishmania spp.)などである。結核菌(Mycobacterium tuberculosis)のような他の細菌は補体による溶解を阻止する保護カプセル中に生存する。[108] 多くの病原体が宿主の免疫応答を弱め方向を間違うような化学物を分泌する。[105] 細菌の中には免疫系の細胞やタンパク質から守るために生物的フィルムを形成するものがある。そのような生物的フィルムは多くの感染成功例に見られ、例えば嚢胞性線維症が特徴の慢性緑膿菌感染やバークホルデリア・セノセパシア感染がある。[109] ほかに抗体に結合する表面タンパク質を発現して抗体の効力を落とす細菌がある。この例には連鎖球菌(Gタンパク質)、黄色ブドウ球菌(Aタンパク質)、ペプトスプレプトコッカス・マグナス(Lタンパク質)がある。[110]
ウイルスが適応免疫系から免れる機構はもっと込み入っている。簡単な方法は、必須なエピトープは隠しもって全く必須でないウイルス表面上のエピトープを素早く変化させることである(アミノ酸か糖あるいは両方)。例えばHIVは、宿主のターゲット細胞に侵入するのに必須なウイルス外膜のタンパク質に絶えず突然変異を起こす。抗原のこれら頻繁な変化はこれらのタンパク質を対象とするワクチンを失敗させていることを説明するだろう。抗原を宿主分子でマスクする方法は宿主細胞から逃れるのによく見られる戦略である。[111] HIVではウイルスを覆う外膜は宿主細胞のもっとも外側の膜から作られている。このような"自己を覆い隠す"ウイルスは免疫系が"非自己"と認識するのを困難にしている。[112]
免疫学の歴史
免疫学は免疫系の構造と機能を研究する科学である。これは医学から生まれ初期の研究は病気に対する免疫の原因についてであった。免疫に最初に言及したのは、知られる限りでは、BC430年のアテネの悪疫流行の間である。ツキジデスは、以前病気にかかって回復した人々は患者を看護しても2度罹ることはないと記した。[113] このようにして観察された獲得免疫はのちにルイ・パスツールによって探求され、ワクチン接種の開発や病気の微生物原因論の提案に結びついた。[114] パスツールの理論は病気の当時流布していた瘴気論のような理論に真っ向から立ち向かうもので、この証明は1891年にロバート・コッホによってなされた微生物が感染症の原因であることの証明まで待たねばならなかったが、コッホは1905年にノーベル賞に輝いた。[115] 1901年のウォールター・リードによる、黄熱病ウイルス発見の際、ウイルスがヒト病原体として確認された。[116]
免疫学は19世紀終わりに向かって長足の進歩を遂げたが、急速な発展の中に体液性免疫および細胞性免疫の研究[117] で特に重要なのはポール・エールリヒの仕事であり、彼は抗原-抗体反応の特異性の説明に側鎖説を唱えた。体液性免疫の理解に対する貢献は、細胞性免疫研究の立役者であるエリー・メトチニコフと共同で1908年ノーベル賞受賞で認められた。[118]
引用文献
- ^ a b c Beck, Gregory; Gail S. Habicht (November 1996). “Immunity and the Invertebrates” (PDF). Scientific American: 60--66 2007年1月1日閲覧。.
- ^ a b Litman G, Cannon J, Dishaw L (2005). “Reconstructing immune phylogeny: new perspectives”. Nat Rev Immunol 5 (11): 866--79. doi:10.1038/nri1712. PMID 16261174.
- ^ a b c Mayer, Gene (2006年). “Immunology - Chapter One: Innate (non-specific) Immunity”. Microbiology and Immunology On-Line Textbook. USC School of Medicine. 2007年1月1日閲覧。
- ^ Smith A.D. (Ed) Oxford dictionary of biochemistry and molecular biology. (1997) Oxford University Press. ISBN 0-19-854768-4
- ^ a b c d e f g h i j Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1
- ^ Boyton R, Openshaw P (2002). “Pulmonary defences to acute respiratory infection”. Br Med Bull 61: 1--12. doi:10.1093/bmb/61.1.1. PMID 11997295.
- ^ Agerberth B, Gudmundsson G. “Host antimicrobial defence peptides in human disease”. Curr Top Microbiol Immunol 306: 67--90. doi:10.1007/3-540-29916-5_3. PMID 16909918.
- ^ Moreau J, Girgis D, Hume E, Dajcs J, Austin M, O'Callaghan R (2001). “Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus”. Invest Ophthalmol Vis Sci 42 (10): 2347--54. PMID 11527949.
- ^ Hankiewicz J, Swierczek E (1974). “Lysozyme in human body fluids”. Clin Chim Acta 57 (3): 205--9. doi:10.1016/0009-8981(74)90398-2. PMID 4434640.
- ^ Fair W, Couch J, Wehner N (1976). “Prostatic antibacterial factor. Identity and significance”. Urology 7 (2): 169--77. doi:10.1016/0090-4295(76)90305-8. PMID 54972.
- ^ Yenugu S, Hamil K, Birse C, Ruben S, French F, Hall S (2003). “Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli”. Biochem J 372 (Pt 2): 473--83. doi:10.1042/BJ20030225. PMID 12628001.
- ^ Gorbach S (1990). “Lactic acid bacteria and human health”. Ann Med 22 (1): 37--41. doi:10.3109/07853899009147239. PMID 2109988.
- ^ Hill L, Embil J (1986). “Vaginitis: current microbiologic and clinical concepts”. CMAJ 134 (4): 321--31. PMID 3510698.
- ^ Reid G, Bruce A (2003). “Urogenital infections in women: can probiotics help?”. Postgrad Med J 79 (934): 428--32. doi:10.1136/pmj.79.934.428. PMID 12954951.
- ^ Salminen S, Gueimonde M, Isolauri E (2005). “Probiotics that modify disease risk”. J Nutr 135 (5): 1294--8. PMID 15867327.
- ^ Reid G, Jass J, Sebulsky M, McCormick J (2003). “Potential uses of probiotics in clinical practice”. Clin Microbiol Rev 16 (4): 658--72. doi:10.1128/CMR.16.4.658-672.2003. PMID 14557292.
- ^ Medzhitov R (2007). “Recognition of microorganisms and activation of the immune response”. Nature 449 (7164): 819--26. doi:10.1038/nature06246. PMID 17943118.
- ^ Matzinger P (2002). “the danger model: a renewed sense of self”. Science 296 (5566): 301-5. doi:10.1126/science.1071059.
- ^ Kawai T, Akira S (2006). “Innate immune recognition of viral infection”. Nat Immunol 7 (2): 131--7. doi:10.1038/ni1303. PMID 16424890.
- ^ Miller, SB (2006). “Prostaglandins in Health and Disease: An Overview”. Seminars in Arthritis and Rheumatism 36 (1): 37--49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ^ Ogawa Y, Calhoun WJ. (2006). “The role of leukotrienes in airway inflammation”. J Allergy Clin Immunol. 118 (4): 789--98. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ^ Le Y, Zhou Y, Iribarren P, Wang J (2004). “Chemokines and chemokine receptors: their manifold roles in homeostasis and disease”. Cell Mol Immunol 1 (2): 95--104. PMID 16212895.
- ^ Martin P, Leibovich S (2005). “Inflammatory cells during wound repair: the good, the bad and the ugly”. Trends Cell Biol 15 (11): 599--607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ a b Rus H, Cudrici C, Niculescu F (2005). “The role of the complement system in innate immunity”. Immunol Res 33 (2): 103--12. doi:10.1385/IR:33:2:103. PMID 16234578.
- ^ Mayer, Gene (2006年). “Immunology - Chapter Two: Complement”. Microbiology and Immunology On-Line Textbook. USC School of Medicine. 2007年1月1日閲覧。
- ^ a b c d e f Janeway CA, Jr. et al (2005). Immunobiology. (6th ed. ed.). Garland Science. ISBN 0-443-07310-4
- ^ Liszewski M, Farries T, Lublin D, Rooney I, Atkinson J (1996). “Control of the complement system”. Adv Immunol 61: 201--83. doi:10.1016/S0065-2776(08)60868-8. PMID 8834497.
- ^ Sim R, Tsiftsoglou S (2004). “Proteases of the complement system”. Biochem Soc Trans 32 (Pt 1): 21--7. doi:10.1042/BST0320021. PMID 14748705.
- ^ Ryter A (1985). “Relationship between ultrastructure and specific functions of macrophages”. Comp Immunol Microbiol Infect Dis 8 (2): 119--33. doi:10.1016/0147-9571(85)90039-6. PMID 3910340.
- ^ Langermans J, Hazenbos W, van Furth R (1994). “Antimicrobial functions of mononuclear phagocytes”. J Immunol Methods 174 (1--2): 185--94. doi:10.1016/0022-1759(94)90021-3. PMID 8083520.
- ^ May R, Machesky L (2001). “Phagocytosis and the actin cytoskeleton”. J Cell Sci 114 (Pt 6): 1061--77. PMID 11228151.
- ^ Salzet M, Tasiemski A, Cooper E (2006). “Innate immunity in lophotrochozoans: the annelids”. Curr Pharm Des 12 (24): 3043--50. doi:10.2174/138161206777947551. PMID 16918433.
- ^ Zen K, Parkos C (2003). “Leukocyte-epithelial interactions”. Curr Opin Cell Biol 15 (5): 557--64. doi:10.1016/S0955-0674(03)00103-0. PMID 14519390.
- ^ a b Stvrtinova', Viera; Ja'n Jakubovsky' and Ivan Huli'n (1995). Inflammation and Fever from Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press 2007年1月1日閲覧。
- ^ Bowers, William (2006年). “Immunology -Chapter Thirteen: Immunoregulation”. Microbiology and Immunology On-Line Textbook. USC School of Medicine. 2007年1月4日閲覧。
- ^ a b Guermonprez P, Valladeau J, Zitvogel L, The'ry C, Amigorena S (2002). “Antigen presentation and T cell stimulation by dendritic cells”. Annu Rev Immunol 20: 621--67. doi:10.1146/annurev.immunol.20.100301.064828. PMID 11861614.
- ^ Krishnaswamy G, Ajitawi O, Chi D. “The human mast cell: an overview”. Methods Mol Biol 315: 13--34. PMID 16110146.
- ^ Kariyawasam H, Robinson D (2006). “The eosinophil: the cell and its weapons, the cytokines, its locations”. Semin Respir Crit Care Med 27 (2): 117--27. doi:10.1055/s-2006-939514. PMID 16612762.
- ^ Middleton D, Curran M, Maxwell L (2002). “Natural killer cells and their receptors”. Transpl Immunol 10 (2--3): 147--64. doi:10.1016/S0966-3274(02)00062-X. PMID 12216946.
- ^ Pancer Z, Cooper M (2006). “The evolution of adaptive immunity”. Annu Rev Immunol 24: 497--518. doi:10.1146/annurev.immunol.24.021605.090542. PMID 16551257.
- ^ Holtmeier W, Kabelitz D. “gammadelta T cells link innate and adaptive immune responses”. Chem Immunol Allergy 86: 151--83. PMID 15976493.
- ^ a b “Understanding the Immune System: How it Works” (PDF). National Institute of Allergy and Infectious Diseases (NIAID). 2007年1月1日閲覧。
- ^ Harty J, Tvinnereim A, White D (2000). “CD8+ T cell effector mechanisms in resistance to infection”. Annu Rev Immunol 18: 275--308. doi:10.1146/annurev.immunol.18.1.275. PMID 10837060.
- ^ a b Radoja S, Frey A, Vukmanovic S (2006). “T-cell receptor signaling events triggering granule exocytosis”. Crit Rev Immunol 26 (3): 265--90. PMID 16928189.
- ^ Abbas A, Murphy K, Sher A (1996). “Functional diversity of helper T lymphocytes”. Nature 383 (6603): 787--93. doi:10.1038/383787a0. PMID 8893001.
- ^ McHeyzer-Williams L, Malherbe L, McHeyzer-Williams M (2006). “Helper T cell-regulated B cell immunity”. Curr Top Microbiol Immunol 311: 59--83. doi:10.1007/3-540-32636-7_3. PMID 17048705.
- ^ Kovacs B, Maus M, Riley J, Derimanov G, Koretzky G, June C, Finkel T (2002). “Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation”. Proc Natl Acad Sci U S a 99 (23): 15006--11. doi:10.1073/pnas.232058599. PMID 12419850.
- ^ Grewal I, Flavell R (1998). “CD40 and CD154 in cell-mediated immunity”. Annu Rev Immunol 16: 111--35. doi:10.1146/annurev.immunol.16.1.111. PMID 9597126.
- ^ Girardi M (2006). “Immunosurveillance and immunoregulation by γδ T cells”. J Invest Dermatol 126 (1): 25--31. doi:10.1038/sj.jid.5700003. PMID 16417214.
- ^ Holtmeier W, Kabelitz D (2005). “γδ T cells link innate and adaptive immune responses”. Chem Immunol Allergy 86: 151--183. doi:10.1159/000086659. PMID 15976493.
- ^ a b Sproul T, Cheng P, Dykstra M, Pierce S (2000). “A role for MHC class II antigen processing in B cell development”. Int Rev Immunol 19 (2--3): 139--55. doi:10.3109/08830180009088502. PMID 10763706.
- ^ Kehry M, Hodgkin P (1994). “B-cell activation by helper T-cell membranes”. Crit Rev Immunol 14 (3--4): 221--38. PMID 7538767.
- ^ Bowers, William (2006年). “Immunology - Chapter nine: Cells involved in immune responses”. Microbiology and Immunology On-Line Textbook. USC School of Medicine. 2007年1月4日閲覧。
- ^ M.N. Alder, I.B. Rogozin, L.M. Iyer, G.V. Glazko, M.D. Cooper, Z. Pancer (2005). “Diversity and Function of Adaptive Immune Receptors in a Jawless Vertebrate”. Science 310 (5756): 1970--1973. doi:10.1126/science.1119420. PMID 16373579.
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (1999). “Dynamics of immunoglobulins at the feto-maternal interface”. Rev Reprod 4 (2): 81--9. doi:10.1530/ror.0.0040081. PMID 10357095.
- ^ Van de Perre P (2003). “Transfer of antibody via mother's milk”. Vaccine 21 (24): 3374--6. doi:10.1016/S0264-410X(03)00336-0. PMID 12850343.
- ^ Keller, Margaret A. and E. Richard Stiehm (2000). “Passive Immunity in Prevention and Treatment of Infectious Diseases”. Clinical Microbiology Reviews 13 (4): 602--614. doi:10.1128/CMR.13.4.602-614.2000. PMID 11023960.
- ^ Death and DALY estimates for 2002 by cause for WHO Member States. World Health Organization. Retrieved on 2007-01-01.
- ^ Singh M, O'Hagan D (1999). “Advances in vaccine adjuvants”. Nat Biotechnol 17 (11): 1075--81. doi:10.1038/15058. PMID 10545912.
- ^ Aw D, Silva A, Palmer D (2007). “Immunosenescence: emerging challenges for an ageing population”. Immunology 120 (4): 435--446. doi:10.1111/j.1365-2567.2007.02555.x. PMID 17313487.
- ^ a b c d Chandra, RK (1997). “Nutrition and the immune system: an introduction”. American Journal of Clinical Nutrition Vol 66: 460S--463S. PMID 9250133. Free full-text pdf available
- ^ Miller JF (2002). “The discovery of thymus function and of thymus-derived lymphocytes”. Immunol. Rev. 185: 7--14. PMID 12190917.
- ^ Joos L, Tamm M (2005). “Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy”. Proc Am Thorac Soc 2 (5): 445--8. doi:10.1513/pats.200508-097JS. PMID 16322598.
- ^ Copeland K, Heeney J (1996). “T helper cell activation and human retroviral pathogenesis”. Microbiol Rev 60 (4): 722--42. PMID 8987361.
- ^ Miller J (1993). “Self-nonself discrimination and tolerance in T and B lymphocytes”. Immunol Res 12 (2): 115--30. doi:10.1007/BF02918299. PMID 8254222.
- ^ a b c d Ghaffar, Abdul (2006年). “Immunology - Chapter Seventeen: Hypersensitivity Reactions”. Microbiology and Immunology On-Line Textbook. USC School of Medicine. 2007年1月1日閲覧。
- ^ Bickle T, Kru"ger D (1993). “Biology of DNA restriction”. Microbiol Rev 57 (2): 434--50. PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, et al (March 2007). “CRISPR provides acquired resistance against viruses in prokaryotes”. Science (journal) 315 (5819): 1709--12. doi:10.1126/science.1138140. PMID 17379808.
- ^ Brouns SJ, Jore MM, Lundgren M, et al (August 2008). “Small CRISPR RNAs guide antiviral defense in prokaryotes”. Science (journal) 321 (5891): 960--4. doi:10.1126/science.1159689. PMID 18703739.
- ^ Stram Y, Kuzntzova L. (2006). “Inhibition of viruses by RNA interference”. Virus Genes 32 (3): 299--306. doi:10.1007/s11262-005-6914-0. PMID 16732482.
- ^ a b Schneider, David (Spring 2005). “Innate Immunity - Lecture 4: Plant immune responses”. Stanford University Department of Microbiology and Immunology. 2007年1月1日閲覧。
- ^ Baulcombe D (2004). “RNA silencing in plants”. Nature 431 (7006): 356--63. doi:10.1038/nature02874. PMID 15372043.
- ^ Morgan R et al. (2006). “Cancer regression in patients after transfer of genetically engineered lymphocytes”. Science 314: 126--129. doi:10.1126/science.1129003. PMID 16946036.
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (2006). “Cytotoxic T cells”. J Invest Dermatol 126 (1): 32--41. doi:10.1038/sj.jid.5700001. PMID 16417215.
- ^ Boon T, van der Bruggen P (1996). “Human tumor antigens recognized by T lymphocytes”. J Exp Med 183: 725--29. doi:10.1084/jem.183.3.725. PMID 8642276.
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G (2000). “T cell recognition of melanoma-associated antigens”. J Cell Physiol 182: 323--31. doi:10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-#. PMID 10653598.
- ^ a b Romero P, Cerottini JC, Speiser DE (2006). “The human T cell response to melanoma antigens”. Adv Immunol. 92: 187--224. doi:10.1016/S0065-2776(06)92005-7. PMID 17145305.
- ^ a b Guevara-Patino JA, Turk MJ, Wolchok JD, Houghton AN (2003). “Immunity to cancer through immune recognition of altered self: studies with melanoma”. Adv Cancer Res. 90: 157--77. doi:10.1016/S0065-230X(03)90005-4. PMID 14710950.
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G (2001). “A listing of human tumor antigens recognized by T cells”. Cancer Immunol Immunother 50: 3--15. doi:10.1007/s002620000169. PMID 11315507.
- ^ Gerloni M, Zanetti M. (2005). “CD4 T cells in tumor immunity”. . Springer Semin Immunopathol 27 (1): 37--48. doi:10.1007/s00281-004-0193-z. PMID 15965712.
- ^ a b Seliger B, Ritz U, Ferrone S (2006). “Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation”. Int J Cancer 118 (1): 129--38. doi:10.1002/ijc.21312. PMID 16003759.
- ^ Hayakawa Y, Smyth MJ. (2006). “Innate immune recognition and suppression of tumors”. Adv Cancer Res 95: 293--322. doi:10.1016/S0065-230X(06)95008-8. PMID 16860661.
- ^ a b Seliger B (2005). “Strategies of tumor immune evasion”. BioDrugs 19 (6): 347--54. doi:10.2165/00063030-200519060-00002. PMID 16392887.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (2006). “Targeting tumor-related immunosuppression for cancer immunotherapy”. Endocr Metab Immune Disord Drug Targets 6 (3): 233--7. doi:10.2174/187153006778250019. PMID 17017974.
- ^ Stix, Gary (July 2007). “A Malignant Flame” (PDF). Scientific American: 60--67 2007年1月1日閲覧。.
- ^ Wira, CR; Crane-Godreau M, Grant K (2004). “Endocrine regulation of the mucosal immune system in the female reproductive tract”. In In: Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.). Mucosal Immunology. San Francisco: Elsevier. ISBN 0124915434
- ^ Lang, TJ (2004). “Estrogen as an immunomodulator”. Clin Immunol 113: 224–230. doi:10.1016/j.clim.2004.05.011. PMID 15507385.
Moriyama, A; Shimoya K, Ogata I et al. (1999). “Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle”. Molecular Human Reproduction 5: 656–661. doi:10.1093/molehr/5.7.656. PMID 10381821.
Cutolo, M; Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). “Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity”. Lupus 13: 635–638. doi:10.1191/0961203304lu1094oa. PMID 15485092.
King, AE; Critchley HOD, Kelly RW (2000). “Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial role”. Molecular Human Reproduction 6: 191–196. doi:10.1093/molehr/6.2.191. PMID 10655462. - ^ Fimmel; Zouboulis CC (2005). “Influence of physiological androgen levels on wound healing and immune status in men”. Aging Male 8: 166–174. doi:10.1080/13685530500233847. PMID 16390741.
- ^ Dorshkind, K; Horseman ND (2000). “The Roles of Prolactin, Growth Hormone, Insulin-Like Growth Factor-I, and Thyroid Hormones in Lymphocyte Development and Function: Insights from Genetic Models of Hormones and Hormone Receptor Deficiency”. Endocrine Reviews 21: 292–312. doi:10.1210/er.21.3.292. PMID 10857555.
- ^ Nagpal, Sunil; Songqing Naand and Radhakrishnan Rathnachalam (2005). “Noncalcemic Actions of Vitamin D Receptor Ligands”. Endocrine Reviews 26 (5): 662–687. doi:10.1210/er.2004-0002. PMID 15798098..
- ^ Hertoghe, T (2005). “The “multiple hormone deficiency” theory of aging: Is human senescence caused mainly by multiple hormone deficiencies?”. Annals of the New York Academy of Science 1051: 448–465. doi:10.1196/annals.1322.035. PMID 16399912.
- ^ Klein, JR (2006). “The immune system as a regulator of thyroid hormone activity”. Exp Biol Med 231: 229–236. PMID 16514168.
- ^ Lange, T; Perras B, Fehm HL, Born J (2003). “Sleep Enhances the Human Antibody response to Hepatitis A Vaccination”. Psychosomatic Medicine 65: 831–835. doi:10.1097/01.PSY.0000091382.61178.F1. PMID 14508028.
- ^ Khansari, DN; Murgo AJ, Faith RE (1990). “Effects of stress on the immune system”. Immunology Today 11: 170–175. doi:10.1016/0167-5699(90)90069-L. PMID 2186751.
- ^ Pond, CM (2005). “Adipose tissue and the immune system”. Prostaglandins, Leukotrienes, and Essential Fatty Acids 73: 17--30. doi:10.1016/j.plefa.2005.04.005. PMID 15946832.
- ^ Langley-Evans, SC; Carrington LJ (2006). “Diet and the developing immune system”. Lupus 15: 746–752. doi:10.1177/0961203306070001. PMID 17153845.
- ^ Spelman, K; Burns J, Nichols D, Winters N, Ottersberg S, Tenborg M (2006). “Modulation of cytokine expression by traditional medicines: a review of herbal immunomodulators”. Alternative Medicine reviews 11: 128–150. PMID 16813462.
Brush, J; Mendenhall E, Guggenheim A, Chan T, Connelly E, Soumyanth A, Buresh R, Barrett R, Zwickey H (2006). “The effect of Echinacea purpurea, Astragalus membranaceus and Glycyrrhiza glabra on CD69 expression and immune cell activation in humans”. Phytotherapy Research 20: 687–695. doi:10.1002/ptr.1938. PMID 16807880. - ^ a b Taylor A, Watson C, Bradley J (2005). “Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy”. Crit Rev Oncol Hematol 56 (1): 23--46. doi:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ^ Barnes P (2006). “Corticosteroids: the drugs to beat”. Eur J Pharmacol 533 (1--3): 2--14. doi:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ^ Masri M (2003). “The mosaic of immunosuppressive drugs”. Mol Immunol 39 (17--18): 1073--7. doi:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ^ Welling GW, Wiejer WJ, van der Zee R, Welling-Werster S. (1985). “Prediction of sequential antigenic regions in proteins”. J Mol Recognit 88 (2): 215--8. PMID 2411595.
- ^ Sollner J, Mayer B. (2006). “Machine learning approaches for prediction of linear B-cell epitopes on proteins”. Journal of Molecular Recognition 19 (3): 200--8. doi:10.1002/jmr.771. PMID 16598694.
- ^ Saha S, Bhasin M, Raghava GP. (2005). “Bcipep: a database of B-cell epitopes”. BMC Bioinformatics 6 (1): 79. doi:10.1186/1471-2105-6-79. PMID 15921533.
- ^ Flower DR, Doytchinova IA. (2002). “Immunoinformatics and the prediction of immunogenicity”. Appl Bioinformatics 1 (4): 167--76. PMID 15130835.
- ^ a b Finlay B, McFadden G (2006). “Anti-immunology: evasion of the host immune system by bacterial and viral pathogens”. Cell 124 (4): 767--82. doi:10.1016/j.cell.2006.01.034. PMID 16497587.
- ^ Cianciotto NP. (2005). “Type II secretion: a protein secretion system for all seasons”. Trends Microbiol. 13 (12): 581--8. doi:10.1016/j.tim.2005.09.005. PMID 16216510.
- ^ Winstanley C, Hart CA (2001). “Type III secretion systems and pathogenicity islands”. J Med Microbiol. 50 (2): 116--26. PMID 11211218.
- ^ Finlay B, Falkow S (1997). “Common themes in microbial pathogenicity revisited”. Microbiol Mol Biol Rev 61 (2): 136--69. PMID 9184008.
- ^ Kobayashi H (2005). “Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections”. Treat Respir Med 4 (4): 241--53. doi:10.2165/00151829-200504040-00003. PMID 16086598.
- ^ Housden N, Harrison S, Roberts S, Beckingham J, Graille M, Stura E, Gore M (2003). “Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus”. Biochem Soc Trans 31 (Pt 3): 716--8. doi:10.1042/BST0310716. PMID 12773190.
- ^ Burton, Dennis R.; Robyn L. Stanfield and Ian A. Wilson (2005). “Antibody vs. HIV in a clash of evolutionary titans”. Proc Natl Acad Sci U S A. 102 (42): 14943--8. doi:10.1073/pnas.0505126102. PMID 16219699.
- ^ Cantin R, Methot S, Tremblay MJ. (2005). “Plunder and stowaways: incorporation of cellular proteins by enveloped viruses”. J Virol. 79 (11): 6577–87. doi:10.1128/JVI.79.11.6577-6587.2005. PMID 15890896.
- ^ Retief F, Cilliers L (1998). “The epidemic of Athens, 430-426 BC”. S Afr Med J 88 (1): 50--3. PMID 9539938.
- ^ Plotkin S (2005). “Vaccines: past, present and future”. Nat Med 11 (4 Suppl): S5--11. doi:10.1038/nm1209. PMID 15812490.
- ^ The Nobel Prize in Physiology or Medicine 1905 Nobelprize.org Accessed January 8 2007.
- ^ Major Walter Reed, Medical Corps, U.S. Army Walter Reed Army Medical Center. Accessed January 8 2007.
- ^ Metchnikoff, Elie; Translated by F.G. Binnie. (1905) (Full Text Version: Google Books). Immunity in Infective Diseases. Cambridge University Press. ISBN 68025143
- ^ The Nobel Prize in Physiology or Medicine 1908 Nobelprize.org Accessed January 8 2007
