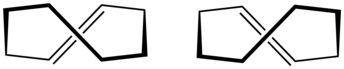
trans-シクロオクテン
| trans-シクロオクテン | |
|---|---|
| |
(E)-Cyclooctene | |
別称 trans-Cyclooctene | |
| 識別情報 | |
| CAS登録番号 | 931-89-5 |
| PubChem | 5463599 |
| ChemSpider | 10265272 |
| EC番号 | 213-245-5 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | C8H14 |
| モル質量 | 110.2 g mol−1 |
| 外観 | 無色液体 |
| 密度 | 0.848 g/mL |
| 融点 |
-59 °C, 214 K, -74 °F |
| 沸点 |
143 °C (1 atm); 68-72 °C (100 torr)[1] |
| 危険性 | |
| GHSピクトグラム |  
|
| GHSシグナルワード | 危険(DANGER) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
trans-シクロオクテン(trans-cyclooctene)は、化学式 [–(CH2)6CH=CH–] を持つ環状炭化水素であり、C-C二重結合に隣接した2つのC-C単結合が二重結合の平面の逆側(トランス配置)にある。不愉快な香りを持つ無色の液体である。
シクロオクテンはそのtrans-異性体が容易に単離される最小のシクロアルケンとして注目に値する。cis-異性体のほうがかなり安定である[2]。trans体およびcis体の環ひずみエネルギーはそれぞれ16.7および7.4 kcal/molである[3]。
 |
|
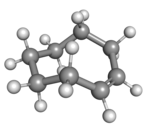
| cis-シクロオクテン (いす形配座) |
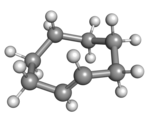
(Rp)-trans-シクロオクテン (かんむり形配座) |
環の炭素原子を平面に配置するとひずみが大きくなり過ぎるため、trans体の安定配座において環は折れ曲がっている(平面でない)。計算では、環平面の上下に炭素原子が交互に出ているかんむり形配座が最も安定であることが示されている[4]。半いす形配座はかんむり形配座よりもおよそ6 kcal/mol不安定であると予測されている[4]。
trans-シクロオクテンの全ての配座はキラル(具体的に言うと、面性キラリティーと呼ばれるもの)であり、鏡像異性体を分離することができる[5][6][7]。理屈の上では、–CH=CH– 基全体を、厳密に、180° ひねることによって、結合の切断を伴うことなく鏡像異性体間の変換を行うことができる。しかしながら、これには混雑した環を水素原子の1つが通過する必要がある[5]。
調製[編集]
trans-シクロオクテンはヨウ化N,N,N-トリメチルシクロオクチルアンモニウムのホフマン脱離を使って、アーサー・C・コープによって予備的スケールで初めて合成された[8]。この反応ではcis体とtrans体の混合物が得られ、trans体は硝酸銀との錯体として選択的に補足される。
cis体から数段階でtrans体を合成する手法もいくつか存在する。例えば、cis体を1,2-エポキシシクロオクタンに変換し、続いて、リチウムジフェニルホスフィド((LiPPh2)とヨウ化メチル(CH3I)と反応させることでほぼ100%の収率で調製することができる[1]。
加えて、直接的なcis–trans異性化のための光化学的手法も存在する。この平衡はより安定なcis体に強く傾いているものの、trans体を銀イオンで補足することで反応をtrans体に向けて駆動することができる[9][10]。
反応[編集]
二重結合上の高い内部ひずみにより、trans体はcis体や典型的な不飽和炭化水素よりも反応性が高い。 例えば、trans体の二重結合はテトラジンやその誘導体とすばやく付加する[4]。また、ルテニウム触媒を使うと開環メタセシス反応によってすばやくポリマー化する[3]。
出典[編集]
- ^ a b Edwin Vedejs, Karel A. J. Snoble, and Philip L. Fuchs (1973). “Phosphorus betaines derived from cycloheptene and cyclooctene oxides. Inversion of cyclooctenes”. J. Org. Chem. 38 (6): 1178–1183. doi:10.1021/jo00946a024.
- ^ Neuenschwander, Ulrich; Hermans, Ive (2011). “The conformations of cyclooctene: Consequences for epoxidation chemistry”. J. Org. Chem. 76 (24): 10236–10240. doi:10.1021/jo202176j. PMID 22077196.
- ^ a b Ron Walker, Rosemary M. Conrad, and Robert H. Grubbs (2009). “The living ROMP of trans-cyclooctene”. Macromolecules 42 (3): 599–605. doi:10.1021/ma801693q.
- ^ a b c Ramajeyam Selvaraj, Joseph M Fox. “trans-Cyclooctene — a stable, voracious dienophile for bioorthogonal labeling”. Current Opinion in Chemical Biology 17 (5): 753-760. doi:10.1016/j.cbpa.2013.07.031.
- ^ a b Arthur C. Cope, C. R. Ganellin, H. W. Johnson, T. V. Van Auken, and Hans J. S. Winkler (1963). “Molecular asymmetry of olefins. I. Resolution of trans-cyclooctene”. J. Am. Chem. Soc. 85 (20): 3276–3279. doi:10.1021/ja00903a049.
- ^ Arthur C. Cope and Anil S. Mehta (1964). “Molecular asymmetry of olefins. II. The absolute configuration of trans-cyclooctene”. J. Am. Chem. Soc. 86 (24): 5626–5630. doi:10.1021/ja01078a044.
- ^ Steven D. Paget (2001). "(−)-Dichloro(ethylene)(α-methylbenzylamine)platinum(II)". Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rd119. ISBN 0471936235。
- ^ Cope, Arthur C.; Bach, Robert D. (1969). "trans-Cyclooctene". Organic Syntheses (英語). 49: 39.; Collective Volume, vol. 5, p. 315
- ^ John S. Swenton (1969). “Photoisomerization of cis-cyclooctene to trans-cyclooctene”. J. Org. Chem. 34 (10): 3217–3218. doi:10.1021/jo01262a102.
- ^ Royzen, Maksim; Yap, Glenn P. A.; Fox, Joseph M. (2008). “A photochemical synthesis of functionalized trans-cyclooctenes driven by metal complexation”. J. Am. Chem. Soc. 130 (12): 3760–3761. doi:10.1021/ja8001919. PMID 18321114.
