染色体外DNA
染色体外DNA(せんしょくたいがいDNA、英: extrachromosomal DNA)は、染色体から離れて細胞核の内部または外部に存在するDNAを指す。各個体のゲノムの大部分のDNAは核内の染色体に存在している一方で、細胞内には複数の形態の染色体外DNAも存在する。これらの一部は重要な生物学的機能を果たしており[1]、またがんなどの疾患に関与している場合もある[2][3][4]。
ウイルス由来以外の染色体外DNAは、原核生物では主にプラスミドとして存在し、真核生物では主にオルガネラ内に存在する[1]。ミトコンドリアDNAは真核生物における主要な染色体外DNAの1つである[5]。ミトコンドリアが自身のDNAを持っていることは、このオルガネラが太古の真核細胞に取り込まれた細菌細胞に由来するものであるという仮説を支持する証拠の1つとなっている[6]。染色体外DNAは同定と単離が容易であるため、複製の研究に用いられることも多い[1]。
染色体外環状DNA(eccDNA)は正常な真核細胞にも存在するが、がん細胞の核では正常細胞には存在しない、ドライバーがん遺伝子を多コピー有する染色体外DNA(ecDNA)が同定される[3][7][8]。こうした染色体外DNAは遺伝子増幅の主要機構であると考えられており、がんドライバー遺伝子を多コピー有することで非常にアグレッシブながんとなる。
原核生物[編集]
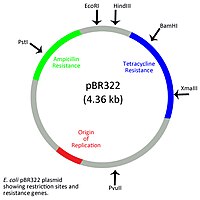
原核生物は真核生物のような膜結合型の核を持たないが、主に染色体が存在する核様体とよばれる領域が存在する。原核生物の染色体外DNAは、核様体以外の領域に環状または線状のプラスミドとして存在する。細菌のプラスミドの配列は1 kbから数百kbと短いことが一般的であり、染色体と独立して複製を行うための複製起点を持つ[9]。各プラスミドの細胞内での総数はコピー数と呼ばれ、1細胞あたり少ないものでは2コピー、多いものでは数百コピーに達するものまでさまざまである[10]。細菌の環状プラスミドは、コードしている遺伝子の機能によって分類される。Fプラスミド(fertility plasmid)と呼ばれるものは接合を可能にし、Rプラスミド(薬剤耐性プラスミド、resistance plasmid)と呼ばれるものはアンピシリンやテトラサイクリンなどさまざまな抗生物質に対する耐性を付与する遺伝子を有している。病原性プラスミド(virulence plasmid)には、細菌が病原性を発揮するために必要な遺伝的エレメントが含まれている。分解プラスミド(degradative plasmid)には、芳香族化合物や生体異物などさまざまな物質の分解を可能にする遺伝子が含まれている[11]。細菌のプラスミドには、色素産生、窒素固定、重金属耐性などの機能を果たしているものもある[12]。
天然に存在する環状プラスミドは複数の耐性遺伝子といくつかのユニークな制限部位を有するよう改変することができ、こうして改変されたプラスミドは生物工学におけるクローニングベクターとして有用なツールとなっている[9]。また、細菌の環状プラスミドはDNAワクチン生産の基盤にもなる。プラスミドDNAワクチンは病原性のウイルスや細菌、その他の寄生虫が産生する抗原またはタンパク質をコードする遺伝子を持つよう遺伝的改変がなされている[13]。宿主へ送達されると、プラスミドにコードされた遺伝子の産物が宿主の自然免疫系と獲得免疫系の双方を刺激する。宿主の免疫応答を高めるため、プラスミドは送達に先立って何らかのアジュバントで被覆されることが多い[14]。
ライム病の病原体であるボレリア属Borreliaを含む数種のスピロヘータ、ストレプトマイセス属Streptomycesの数種のグラム陽性土壌細菌、硫黄を酸化するグラム陰性菌Thiobacillus versutusには、線状のプラスミドが同定されている。原核生物の線状プラスミドはヘアピンループ構造を持つか、もしくはDNA分子の末端にタンパク質が共有結合している。ボレリア属のプラスミドのアデニンとチミンに富むヘアピンループ構造は、大きさは5 kbから200 kb以上までさまざまであり、感染宿主の免疫応答を回避するための主要な表面タンパク質(主要抗原)の産生を担う遺伝子が含まれている。DNA鎖の5'末端に共有結合的に付加されたタンパク質を持つ線状プラスミドは、invertronと呼ばれている。サイズは9 kbから600 kb以上のものまであり、逆位反復配列から構成されている[15]。共有結合的に付加されたタンパク質は細菌の接合やプラスミドのゲノムへの組み込みを補助している可能性がある。この種類の線状プラスミドは染色体外DNAとして最大のクラスを構成しており、特定の細菌細胞内に存在しているだけでなく、真核生物細胞内に存在するすべての線状染色体外DNAもまた、タンパク質が5'末端に付加されたinvertron構造を利用している[15][16]。
ある種の古細菌には、ボーグと呼ばれる長い線状のDNAが共存しており、そこにコードされている遺伝子の多くは宿主のものと共通している。ボーグは未知の染色体外DNA構造の一形態である可能性がある[17][18][19]。
真核生物[編集]
ミトコンドリア[編集]

真核細胞内に存在するミトコンドリアのマトリックスには、ミトコンドリアDNA(mtDNA)が複数コピー含まれている[20]。ヒトを含む多細胞動物では、環状のmtDNAには電子伝達系の一部となるタンパク質をコードする13個の遺伝子とミトコンドリアRNAをコードする24個の遺伝子(rRNA遺伝子が2個、tRNA遺伝子が22個)が含まれている[21]。動物のmtDNAのサイズは約16.6kbであり、tRNAやrRNAをコードする遺伝子が含まれているものの、mtDNAの複製やミトコンドリアタンパク質の翻訳には核遺伝子にコードされるタンパク質が必要である[22]。mtDNAにはコーディング配列を持たない長い領域が1か所存在する。この1 kbの領域はDループ領域として知られ、核にコードされる調節タンパク質が結合する[21]。ミトコンドリアあたりのmtDNAの分子数は種によって異なり、また各細胞のエネルギー需要によって細胞間でも異なる。一例として、筋肉や肝細胞では血球細胞や皮膚の細胞よりも1ミトコンドリアあたりのmtDNAのコピー数は多い[22]。mtDNAはミトコンドリア内膜の電子伝達系や活性酸素種産生の場に近接して位置しており、またmtDNA分子はヒストンなどによって保護されていないため、核DNAよりも損傷感受性が高い[23]。mtDNAの損傷が起こった場合には、DNAは塩基除去修復経路によって修復されるか、もしくは損傷したmtDNA分子が破壊される(mtDNAは各ミトコンドリアに複数コピー存在するため、ミトコンドリアに悪影響が生じることはない)[24]。
核遺伝子を翻訳するための標準的な遺伝暗号は普遍的である。すなわち、DNAがどの生物種に由来するものであっても、DNAの各3塩基(コドン)は同じアミノ酸をコードしている。この暗号はきわめて普遍的であるものの、菌類、動物、原生生物、植物のミトコンドリアDNAではわずかに異なっている[20]。これらの生物種のmtDNAでは、大部分のコドンは核の遺伝暗号と同じアミノ酸をコードするものの、いくつかでは異なる。
| 遺伝暗号 | Translation
table[25] |
DNA
コドン |
RNA
コドン |
アミノ酸 | 標準暗号 |
|---|---|---|---|---|---|
| Vertebrate mitochondrial | 2 | AGA
|
AGA
|
Ter (*)
|
Arg (R)
|
AGG
|
AGG
|
Ter (*)
|
Arg (R)
| ||
ATA
|
AUA
|
Met (M)
|
Ile (I)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
| ||
| Yeast mitochondrial | 3 | ATA
|
AUA
|
Met (M)
|
Ile (I)
|
CTT
|
CUU
|
Thr (T)
|
Leu (L)
| ||
CTC
|
CUC
|
Thr (T)
|
Leu (L)
| ||
CTA
|
CUA
|
Thr (T)
|
Leu (L)
| ||
CTG
|
CUG
|
Thr (T)
|
Leu (L)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
| ||
CGA
|
CGA
|
absent
|
Arg (R)
| ||
CGC
|
CGC
|
absent
|
Arg (R)
| ||
| Mold, protozoan, and coelenterate mitochondrial | 4 and 7 | TGA
|
UGA
|
Trp (W)
|
Ter (*)
|
| Invertebrate mitochondrial | 5 | AGA
|
AGA
|
Ser (S)
|
Arg (R)
|
AGG
|
AGG
|
Ser (S)
|
Arg (R)
| ||
ATA
|
AUA
|
Met (M)
|
Ile (I)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
| ||
| Echinoderm and flatworm mitochondrial | 9 | AAA
|
AAA
|
Asn (N)
|
Lys (K)
|
AGA
|
AGA
|
Ser (S)
|
Arg (R)
| ||
AGG
|
AGG
|
Ser (S)
|
Arg (R)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
| ||
| Ascidian mitochondrial | 13 | AGA
|
AGA
|
Gly (G)
|
Arg (R)
|
AGG
|
AGG
|
Gly (G)
|
Arg (R)
| ||
ATA
|
AUA
|
Met (M)
|
Ile (I)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
| ||
| Alternative flatworm mitochondrial | 14 | AAA
|
AAA
|
Asn (N)
|
Lys (K)
|
AGA
|
AGA
|
Ser (S)
|
Arg (R)
| ||
AGG
|
AGG
|
Ser (S)
|
Arg (R)
| ||
TAA
|
UAA
|
Tyr (Y)
|
Ter (*)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
| ||
| Chlorophycean mitochondrial | 16 | TAG
|
UAG
|
Leu (L)
|
Ter (*)
|
| Trematode mitochondrial | 21 | TGA
|
UGA
|
Trp (W)
|
Ter (*)
|
ATA
|
AUA
|
Met (M)
|
Ile (I)
| ||
AGA
|
AGA
|
Ser (S)
|
Arg (R)
| ||
AGG
|
AGG
|
Ser (S)
|
Arg (R)
| ||
AAA
|
AAA
|
Asn (N)
|
Lys (K)
| ||
| Scenedesmus obliquus mitochondrial | 22 | TCA
|
UCA
|
Ter (*)
|
Ser (S)
|
TAG
|
UAG
|
Leu (L)
|
Ter (*)
| ||
| Thraustochytrium mitochondrial | 23 | TTA
|
UUA
|
Ter (*)
|
Leu (L)
|
| Pterobranchia mitochondrial | 24 | AGA
|
AGA
|
Ser (S)
|
Arg (R)
|
AGG
|
AGG
|
Lys (K)
|
Arg (R)
| ||
TGA
|
UGA
|
Trp (W)
|
Ter (*)
|
| アミノ酸の生化学的性質 | 非極性 | 極性 | 塩基性 | 酸性 | 終止コドン |
こうした遺伝暗号の差異は、mRNAと相互作用するtRNAの化学修飾の差異が原因であると考えられている[26]。
葉緑体[編集]
真核生物の葉緑体やその他の色素体にも、染色体外DNA分子が存在する。大部分の葉緑体では1種類の環状染色体にすべての遺伝物質が保持されているが、一部の種ではより小さな環状プラスミドも存在している証拠が得られている[27][28][29]。近年、環状の葉緑体DNA(cpDNA)という従来のモデルには疑問が投げかけられており、cpDNAは線状の形態がより一般的である可能性が示唆されている[30]。1分子のcpDNAには100個から200個の遺伝子が含まれており[31]、そのサイズは種によって異なる。高等植物の場合、cpDNAのサイズはおよそ120–160 kbの範囲である[20]。cpDNA上の遺伝子は、光合成経路に必要な構成要素のほか、tRNAやrRNA、RNAポリメラーゼのサブユニット、リボソームタンパク質がコードされている[32]。mtDNAと同様、cpDNAも完全に自律的であるわけではなく、複製や葉緑体タンパク質の産生には核遺伝子の産物を必要とする。葉緑体には複数コピーのcpDNAが存在し、その数は生物種や細胞種によって異なるだけでなく、同じ細胞でも老化や発生段階によって変化する。一例として、葉緑体が他の種類と区別のつかない原色素体(proplastid)の状態にある発生初期段階の若い細胞では、完全に成熟した葉緑体を持つ細胞よりもコピー数は多い[33]。
環状DNA[編集]
環状染色体外DNA(eccDNA)は全ての真核細胞に存在する。これらは通常はゲノムDNAに由来するものであり、染色体のコーディング領域やノンコーディング領域の双方に存在する反復配列から構成されている。eccDNAのサイズは2 kb以下から20 kb以上までさまざまである[34]。植物では、eccDNAには染色体のセントロメア領域やサテライトDNAに存在するものと類似した反復配列が含まれている[35]。動物では、eccDNAはサテライトDNA、5SリボソームDNA、テロメアDNAにみられる反復配列を含むことが示されている[34]。酵母など特定の生物種ではeccDNAの産生は染色体DNAの複製に依存しているが[35]、哺乳類など他の生物種では複製過程に依存せず形成される[36]。eccDNAの機能について広範な研究は行われていないが、ゲノムDNA配列に由来するeccDNAエレメントの産生は真核生物のゲノムの可塑性を増し、またゲノム安定性、細胞老化、染色体の進化に影響していることが提唱されている[37]。
ヒトのがん細胞では、光学顕微鏡で観察することができる大きなeccDNAが観察される[2][3][4]。がん研究などの分野においては、こうしたものを指して染色体外DNA(ecDNA)という語が用いられることも多い。こうしたがん細胞のecDNAのサイズは、1–3 Mbもしくはそれ以上である[2]。こうした巨大なecDNA分子はがん細胞の核内に存在してがんドライバー遺伝子を複数コピー有しており、これらの遺伝子からは転写が行われていることが示されている。こうした点から、ecDNAはがんの成長に寄与していると考えられている。
ecDNAの同定のための専門ツールが開発されている。
- Paul MischelとVineet Bafnaによって開発されたソフトウェアでは、顕微鏡画像中のecDNAを同定することができる。
- コペンハーゲン大学のBirgitte Regenbergらによって開発されたCircle-Seqという手法では、細胞からecDNAを物理的に単離し、残存する線状DNAを酵素的に除去し、残った環状DNAの配列決定を行うことができる[38]。
ウイルス[編集]
ウイルスDNAは染色体外DNAの一例である。ウイルスゲノムの理解は、ウイルスの進化や変異を理解するうえで非常に重要である[39]。HIVやがんウイルスなど一部のウイルスは、自身のDNAを宿主細胞のゲノム内へ組み込む[40]。
染色体外DNAを構成するウイルスの一例は、ヒトパピローマウイルス(HPV)である。HPVのDNAゲノムの複製は、establishment、maintenance、amplificationという3つの段階で行われる。HPVは性器、肛門、口腔の上皮細胞に感染する。通常、HPVは免疫系によって検知され、除去される。こうしたウイルスDNAの認識は、免疫応答の重要な部分をなしている。HPVが持続感染を行うためには、HPVの環状ゲノムが複製されて細胞分裂時に分配されることで、娘細胞へ受け継がれていく必要がある[41]。
宿主細胞による認識[編集]
細胞は、細胞質に存在する外来DNAを認識することができる。こうした認識経路の理解は、疾患の予防や治療につながる可能性がある[42]。細胞は、Toll様受容体(TLR)経路など、ウイルスDNAを特異的に認識するセンサーを備えている[43]。
Toll経路はまず昆虫において、さまざまな細菌やウイルスのゲノム、病原体関連分子パターン(PAMP)を検知するセンサーとして機能する経路として発見された。PAMPは自然免疫シグナルの強力な活性化因子となることが知られている。ヒトには約10種類のTLRが存在し、各TLRはそれぞれ異なる種類のPAMPを検知する。具体的には、TLR4はリポ多糖を、TLR3はウイルスの二本鎖RNAを、TLR7/TLR8はウイルスの一本鎖RNAを、TLR9はウイルスや細菌の非メチル化DNAをそれぞれ検知する。TLR9は細菌やウイルスの非メチル化CpGを検知するよう進化しており、IFN(I型インターフェロン)やその他のサイトカインの産生を開始する[43]。
遺伝[編集]

染色体外DNAの遺伝様式は、染色体上の核DNAの遺伝とは異なる。染色体とは異なり染色体外DNAにセントロメアは存在せず、そのため非メンデル型の遺伝パターンによって不均質な細胞集団が生じる。ヒトでは、細胞質の事実上すべてのものは母親の卵から遺伝したものであり[44]、mtDNAなどのオルガネラDNAも母親から遺伝したものである。mtDNAやその他の細胞質DNAの変異も母親から遺伝する。こうした片親遺伝は非メンデル性遺伝の一例である。植物もmtDNAは片親遺伝であり、大部分の植物は母親からの遺伝であるが、セコイアSequoia sempervirensは父親からmtDNAを受け継ぐことが知られている[45]。
父親由来のmtDNAが子孫に受け継がれることが稀である理由としては、2つの仮説が提唱されている。1つは、単に父親由来のmtDNAは母親由来のものよりもずっと濃度が低く、そのため子孫では検出されないというものである。もう1つはより複雑な仮説であり、父親由来のmtDNAは分解され、その遺伝が防がれているというものである。mtDNAの片親遺伝は、変異率が高いmtDNAのホモプラズミーを維持するための機構の1つである可能性が提唱されている[45]。
臨床的意義[編集]
真核生物において、染色体外エレメントはゲノム不安定性と関連している。Small polydispersed DNA(spcDNAs)と呼ばれるeccDNAの一種は、ゲノム不安定性とともに検出される。spcDNAはゲノム中のサテライトDNA、レトロウイルス様DNAエレメント、トランスポゾンなどの反復配列に由来し、遺伝的組換えに伴う産物であると考えられている。
がん細胞にみられるecDNAには、光学顕微鏡下で対を形成したクロマチン構造体として観察される、歴史的に二重微小染色体(DM染色体)と呼ばれてきたものも含まれる。単一の構造体として観察されるものも含め、さまざまな組織由来のがん細胞の約半数にはこうしたecDNAが観察されるが、正常細胞で観察されることは事実上ない[3]。ecDNAは染色体の二本鎖切断またはDNAの過剰複製によって生み出されると考えられている。がんやその他ゲノム不安定性を示す症例では、高レベルの染色体外エレメントが観察される場合があることが示されている[5]。
ミトコンドリアDNAは、さまざまな形で疾患の発症に関与している。mtDNAの点変異や組換えは、心臓、中枢神経系、内分泌系、消化器、目、腎臓に影響を及ぼすいくつかの疾患と関連付けられている[21]。ミトコンドリア内に存在するmtDNA量の低下はミトコンドリアDNA枯渇症候群と呼ばれる疾患群の原因となり、肝臓、中枢・末梢神経系、平滑筋や聴力に影響が生じる場合がある[22]。mtDNAのコピー数と特定のがん発症リスクとの関連についての研究結果はまちまちであり、時に矛盾する結果が得られている。乳がんに関しては、mtDNAの増加と減少の双方で発症リスクの増加との関連が示されている。また、mtDNAの増加と腎臓がん発症リスクの増加には正相関が観察されているが、胃がんの場合にはmtDNAとの関連はみられないようである[46]。
原生動物の1グループであるアピコンプレクサには染色体外DNAが存在する。マラリア原虫、AIDS関連病原体(トキソプラズマやクリプトスポリジウム)はいずれもアピコンプレクサに属する。マラリア原虫には約6 kbの線状のミトコンドリアDNA、そして色素体に由来するオルガネラ(アピコプラスト)の約35 kbの環状DNAが存在する[47]。こうしたDNA分子にコードされる遺伝子の産物は抗マラリア薬の標的となる可能性がある[48]。
がんにおけるecDNAの役割[編集]
遺伝子増幅は、がん遺伝子活性化の最も一般的な機構の1つである。がんにおける遺伝子増幅は、染色体外の環状エレメントで生じていることが多い[4][49]。がんにおけるecDNAの主な機能は、迅速に高いコピー数への増幅を達成し、また細胞間での大規模な遺伝的異質性を促進することである[3][8]。がんで最も広く増幅が生じているがん遺伝子はecDNA上に存在して高度に動的な挙動を示し、本来の染色体上の位置とは異なる位置への再組み込みによって均一染色領域(HSR)を形成したり[3][50]、さまざまな治療薬剤に応答してコピー数や構成を変化させたりする[7][51][52]。ecDNAはより進行度や重症度の高いがんの多くの原因となっているほか、抗がん剤耐性の原因にもなっている[53]。
ecDNAの環状構造は染色体DNAの線状構造とは異なり、がんの発症に影響を及ぼす重要な意味を持っている[54]。ecDNA上のがん遺伝子は非常に高度に転写されており、全トランスクリプトームの上位1%に位置する。細菌のプラスミドやミトコンドリアDNAとは異なり、ecDNAはクロマチン化されており、転写活性化もたらすをヒストン標識が高レベルで存在している一方で抑制をもたらす標識は少ない。ecDNAのクロマチン構造には染色体DNAにみられるような高次の凝縮が生じないため、全ゲノム中で最もアクセスしやすいDNA領域となっている。また、ecDNAは核内でクラスターを形成している可能性があり、こうした構造はecDNAハブ(ecDNA hub)と呼ばれる[55]。ecDNAハブは分子間でのエンハンサー-遺伝子間相互作用が可能な空間を形成し、がん遺伝子の過剰発現を促進している可能性がある。
出典[編集]
- ^ a b c “Extrachromosomal DNA in eucaryotes”. Plasmid 14 (3): 177–91. (November 1985). doi:10.1016/0147-619X(85)90001-0. PMID 3912782.
- ^ a b c “Extrachromosomal oncogene amplification in tumour pathogenesis and evolution”. Nature Reviews. Cancer 19 (5): 283–288. (May 2019). doi:10.1038/s41568-019-0128-6. PMC 7168519. PMID 30872802.
- ^ a b c d e f “Extrachromosomal oncogene amplification drives tumour evolution and genetic heterogeneity”. Nature 543 (7643): 122–125. (March 2017). Bibcode: 2017Natur.543..122T. doi:10.1038/nature21356. PMC 5334176. PMID 28178237.
- ^ a b c “Cancer May Be Driven by DNA Outside of Chromosomes” (英語). The Scientist Magazine®. 2021年10月5日閲覧。
- ^ a b “Formation of non-random extrachromosomal elements during development, differentiation and oncogenesis”. Seminars in Cancer Biology 17 (1): 56–64. (February 2007). doi:10.1016/j.semcancer.2006.10.007. PMID 17116402.
- ^ Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2014). Essential Cell Biology (Fourth ed.). New York, New York, USA: Garland Science. p. 449. ISBN 978-0-8153-4454-4
- ^ a b “Targeted therapy resistance mediated by dynamic regulation of extrachromosomal mutant EGFR DNA”. Science 343 (6166): 72–6. (January 2014). Bibcode: 2014Sci...343...72N. doi:10.1126/science.1241328. PMC 4049335. PMID 24310612.
- ^ a b “Discordant inheritance of chromosomal and extrachromosomal DNA elements contributes to dynamic disease evolution in glioblastoma”. Nature Genetics 50 (5): 708–717. (May 2018). doi:10.1038/s41588-018-0105-0. PMC 5934307. PMID 29686388.
- ^ a b Nelson, David (2008). Lehninger Principles of Biochemistry. New York: W. H. Freeman and Company. pp. 307–308. ISBN 978-0-7167-7108-1
- ^ Watson, James (2007). Recombinant RNA: Genes and Genomes- A Short Course. New York: W. H. Freeman and Company. p. 81. ISBN 978-0-7167-2866-5
- ^ “Extrachromosomal genetic elements in Micrococcus”. Applied Microbiology and Biotechnology 97 (1): 63–75. (January 2013). doi:10.1007/s00253-012-4539-5. PMID 23138713.
- ^ Barnum, Susan (2005). Biotechnology- An Introduction. California: Brooks / Cole. pp. 62–63. ISBN 978-0-495-11205-1
- ^ “From plasmids to protection: a review of DNA vaccines against infectious diseases”. International Reviews of Immunology 25 (3–4): 99–123. (2006). doi:10.1080/08830180600785827. PMID 16818367.
- ^ “Mitigating the looming vaccine crisis: production and delivery of plasmid-based vaccines”. Critical Reviews in Biotechnology 31 (1): 32–52. (March 2011). doi:10.3109/07388551.2010.483460. PMID 20879832.
- ^ a b “Linear plasmids and chromosomes in bacteria”. Molecular Microbiology 10 (5): 917–22. (December 1993). doi:10.1111/j.1365-2958.1993.tb00963.x. PMID 7934868.
- ^ “Microbial linear plasmids”. Applied Microbiology and Biotechnology 47 (4): 329–36. (April 1997). doi:10.1007/s002530050936. PMID 9163946.
- ^ Dance, Amber (16 July 2021). “Massive DNA 'Borg' structures perplex scientists” (英語). Nature 595 (7869): 636. Bibcode: 2021Natur.595..636D. doi:10.1038/d41586-021-01947-3.
- ^ Andrew, Shakespeare, William Gurr (2021年7月30日). “Previously undiscovered DNA 'borgs' found on California wetlands” (英語). The Independent 2021年8月13日閲覧。
- ^ Al-Shayeb, Basem; Schoelmerich, Marie C.; West-Roberts, Jacob; Valentin-Alvarado, Luis E.; Sachdeva, Rohan; Mullen, Susan; Crits-Christoph, Alexander; Wilkins, Michael J. et al. (10 July 2021). “Borgs are giant extrachromosomal elements with the potential to augment methane oxidation” (英語). bioRxiv: 2021.07.10.451761. doi:10.1101/2021.07.10.451761 2021年8月13日閲覧。.
- ^ a b c Lodish, Harvey (2013). Molecular Cell Biology, 7th edition. New York: W.H. Freeman and Company. pp. 245–251. ISBN 978-1-4641-2398-6
- ^ a b c “Mitochondrial DNA and disease”. Lancet 354 Suppl 1 (9176): SI17-21. (July 1999). doi:10.1016/S0140-6736(99)90244-1. PMID 10437851.
- ^ a b c “Quantitative evaluation of the mitochondrial DNA depletion syndrome”. Clinical Chemistry 56 (7): 1119–27. (July 2010). doi:10.1373/clinchem.2009.141549. PMID 20448188.
- ^ “Mitochondrial DNA repair pathways”. Journal of Bioenergetics and Biomembranes 31 (4): 391–8. (August 1999). doi:10.1023/A:1005484004167. PMID 10665528.
- ^ “Mitochondrial DNA, chloroplast DNA and the origins of development in eukaryotic organisms”. Biology Direct 5 (42): 42. (June 2010). doi:10.1186/1745-6150-5-42. PMC 2907347. PMID 20587059.
- ^ “NCBI Taxonomy Homepage”. www.ncbi.nlm.nih.gov. 2024年1月16日閲覧。
- ^ “Genetic aspects of mitochondrial genome evolution”. Molecular Phylogenetics and Evolution 69 (2): 328–38. (November 2013). doi:10.1016/j.ympev.2012.10.020. PMID 23142697.
- ^ “Rates and patterns of chloroplast DNA evolution”. Proceedings of the National Academy of Sciences of the United States of America 91 (15): 6795–801. (July 1994). Bibcode: 1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMC 44285. PMID 8041699.
- ^ “Cytogenomic analyses reveal the structural plasticity of the chloroplast genome in higher plants”. The Plant Cell 13 (2): 245–54. (February 2001). doi:10.1105/tpc.13.2.245. PMC 102240. PMID 11226183.
- ^ Aronsson, Henrik; Sandelius, Anna Stina (2009). The chloroplast interactions with the environment ([Online-Ausg.]. ed.). Berlin: Springer. p. 18. ISBN 978-3540686965
- ^ “Circular chloroplast chromosomes: the grand illusion”. The Plant Cell 16 (7): 1661–6. (July 2004). doi:10.1105/tpc.160771. PMC 514151. PMID 15235123.
- ^ “Motif analysis unveils the possible co-regulation of chloroplast genes and nuclear genes encoding chloroplast proteins”. Plant Molecular Biology 80 (2): 177–87. (September 2012). doi:10.1007/s11103-012-9938-6. PMID 22733202.
- ^ “Essential nucleoid proteins in early chloroplast development”. Trends in Plant Science 18 (4): 186–94. (April 2013). doi:10.1016/j.tplants.2012.11.003. PMID 23246438.
- ^ “The loss of DNA from chloroplasts as leaves mature: fact or artefact?”. Journal of Experimental Botany 60 (11): 3005–10. (2009). doi:10.1093/jxb/erp158. PMID 19454766.
- ^ a b “Extrachromosomal circular DNA derived from tandemly repeated genomic sequences in plants”. The Plant Journal 53 (6): 1027–34. (March 2008). doi:10.1111/j.1365-313X.2007.03394.x. PMID 18088310.
- ^ “Replication independent formation of extrachromosomal circular DNA in mammalian cell-free system”. PLOS ONE 4 (7): e6126. (July 2009). Bibcode: 2009PLoSO...4.6126C. doi:10.1371/journal.pone.0006126. PMC 2699479. PMID 19568438.
- ^ “Extrachromosomal circles of satellite repeats and 5S ribosomal DNA in human cells”. Mobile DNA 1 (1): 11. (March 2010). doi:10.1186/1759-8753-1-11. PMC 3225859. PMID 20226008.
- ^ “The curious DNA circles that make treating cancer so hard”. cen.acs.org. 2021年10月2日閲覧。
- ^ “Viral mutation rates”. Journal of Virology 84 (19): 9733–48. (October 2010). doi:10.1128/JVI.00694-10. PMC 2937809. PMID 20660197.
- ^ Silverthorn, Dee Unglaub (2007). Human physiology: an integrated approach (4th ed., [Pearson international edition] ed.). San Francisco: Pearson/Benjamin Cummings. ISBN 978-0-321-39624-2
- ^ “Inactivation of p53 rescues the maintenance of high risk HPV DNA genomes deficient in expression of E6”. PLOS Pathogens 9 (10): e1003717. (October 2013). doi:10.1371/journal.ppat.1003717. PMC 3812038. PMID 24204267.
- ^ “Cytoplasmic DNA innate immune pathways”. Immunological Reviews 243 (1): 99–108. (September 2011). doi:10.1111/j.1600-065X.2011.01051.x. PMID 21884170.
- ^ a b “Innate immune DNA sensing pathways: STING, AIMII and the regulation of interferon production and inflammatory responses”. Current Opinion in Immunology 23 (1): 10–20. (February 2011). doi:10.1016/j.coi.2010.12.015. PMC 3881186. PMID 21239155.
- ^ An Introduction to Genetic Analysis. New York: W.H.Freeman. (2000)
- ^ a b “Maternal inheritance of mitochondrial DNA by diverse mechanisms to eliminate paternal mitochondrial DNA”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research 1833 (8): 1979–84. (August 2013). doi:10.1016/j.bbamcr.2013.03.010. PMID 23524114.
- ^ “Mitochondrial DNA copy number is associated with breast cancer risk”. PLOS ONE 8 (6): e65968. (June 2013). Bibcode: 2013PLoSO...865968T. doi:10.1371/journal.pone.0065968. PMC 3680391. PMID 23776581.
- ^ “Extrachromosomal DNA in the Apicomplexa”. Microbiology and Molecular Biology Reviews 61 (1): 1–16. (March 1997). doi:10.1128/mmbr.61.1.1-16.1997. PMC 232597. PMID 9106361.
- ^ Mukherjee, Avinaba; Sadhukhan, Gobinda Chandra (2016-03). “Anti-malarial Drug Design by Targeting Apicoplasts: New Perspectives”. Journal of Pharmacopuncture 19 (1): 7–15. doi:10.3831/KPI.2016.19.001. ISSN 2093-6966. PMC 4887746. PMID 27280044.
- ^ “Extrachromosomal DNA is associated with oncogene amplification and poor outcome across multiple cancers”. Nature Genetics 52 (8): 891–897. (August 2020). doi:10.1038/s41588-020-0678-2. PMC 7484012. PMID 32807987.
- ^ “Gene amplification as double minutes or homogeneously staining regions in solid tumors: origin and structure”. Genome Research 20 (9): 1198–206. (September 2010). doi:10.1101/gr.106252.110. PMC 2928498. PMID 20631050.
- ^ “Elimination of extrachromosomally amplified MYC genes from human tumor cells reduces their tumorigenicity”. Proceedings of the National Academy of Sciences of the United States of America 89 (17): 8165–9. (September 1992). Bibcode: 1992PNAS...89.8165V. doi:10.1073/pnas.89.17.8165. PMC 49877. PMID 1518843.
- ^ “Structure and evolution of double minutes in diagnosis and relapse brain tumors”. Acta Neuropathologica 137 (1): 123–137. (January 2019). doi:10.1007/s00401-018-1912-1. PMC 6338707. PMID 30267146.
- ^ McKie, Robin; Rose, J. C.; Chen, C. Y.; Pichugin, Y.; Xie, L.; Tang, J.; Hung, K. L.; Yost, K. E. et al. (February 18, 2023). 'Bond villain' DNA could transform cancer treatment, scientists say. 54. pp. 1527–1533. doi:10.1038/s41588-022-01177-x. PMC 9534767. PMID 36123406.
- ^ “Circular ecDNA promotes accessible chromatin and high oncogene expression”. Nature 575 (7784): 699–703. (November 2019). Bibcode: 2019Natur.575..699W. doi:10.1038/s41586-019-1763-5. PMC 7094777. PMID 31748743.
- ^ Hung, King L.; Yost, Kathryn E.; Xie, Liangqi; Shi, Quanming; Helmsauer, Konstantin; Luebeck, Jens; Schöpflin, Robert; Lange, Joshua T. et al. (December 2021). “ecDNA hubs drive cooperative intermolecular oncogene expression” (英語). Nature 600 (7890): 731–736. Bibcode: 2021Natur.600..731H. doi:10.1038/s41586-021-04116-8. ISSN 1476-4687. PMC 9126690. PMID 34819668.
関連文献[編集]
- “Mitochondrial DNA nucleoid structure”. Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms 1819 (9–10): 914–20. (2012). doi:10.1016/j.bbagrm.2011.11.005. PMID 22142616.
- “New insight on the role of extrachromosomal retroviral DNA”. Leukemia 11 (9): 1395–9. (September 1997). doi:10.1038/sj.leu.2400776. PMID 9305590.
- “Extrachromosomal circular DNA of tandemly repeated genomic sequences in Drosophila”. Genome Research 13 (6A): 1133–45. (June 2003). doi:10.1101/gr.907603. PMC 403641. PMID 12799349.
- “Formation of extrachromosomal circles from telomeric DNA in Xenopus laevis”. EMBO Reports 3 (12): 1168–74. (December 2002). doi:10.1093/embo-reports/kvf240. PMC 1308322. PMID 12446568.
- “Extrachromosomal genes: a powerful tool in gene targeting approaches”. Gene Therapy 9 (11): 679–82. (June 2002). doi:10.1038/sj.gt.3301749. PMID 12032686.
- Cummings, Donald (1979). Extrachromosomal DNA. New York: Academic Press Inc.
- “Studies on extrachromosomal DNA elements. Replication of the colicinogenic factor Col E1 in two temperature sensitive mutants of Escherichia coli defective in DNA replication”. European Journal of Biochemistry 15 (2): 311–20. (August 1970). doi:10.1111/j.1432-1033.1970.tb01009.x. PMID 4926129.
- “Extrachromosomal plasmids in the plant pathogenic fungus Rhizoctonia solani”. Current Genetics 25 (5): 423–31. (May 1994). doi:10.1007/BF00351781. PMID 8082188.
- “Extrachromosomal inheritance: hereditary symbionts, mitochondria, chiloroplasts”. Annual Review of Genetics 5: 361–406. (1971). doi:10.1146/annurev.ge.05.120171.002045. PMID 16097660.
- “Extrachromosomal microDNAs and chromosomal microdeletions in normal tissues”. Science 336 (6077): 82–6. (April 2012). Bibcode: 2012Sci...336...82S. doi:10.1126/science.1213307. PMC 3703515. PMID 22403181.
- “One ring to rule them all? Genome sequencing provides new insights into the 'master circle' model of plant mitochondrial DNA structure”. The New Phytologist 200 (4): 978–85. (December 2013). doi:10.1111/nph.12395. PMID 24712049.
- “Sociobiological control of plasmid copy number in bacteria”. PLOS ONE 5 (2): e9328. (February 2010). Bibcode: 2010PLoSO...5.9328W. doi:10.1371/journal.pone.0009328. PMC 2827543. PMID 20195362.
