ロバスタチン
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Mevacor, Altocor, others |
| Drugs.com | monograph |
| MedlinePlus | a688006 |
| ライセンス | US Daily Med:リンク |
| 法的規制 |
|
| 投与経路 | By mouth |
| 薬物動態データ | |
| 生物学的利用能 | <5%[1] |
| 血漿タンパク結合 | >98%[1] |
| 代謝 | Liver (CYP3A and CYP2C8 substrate)[1] |
| 半減期 | 2–5 hours[1] |
| 排泄 | Faeces (83%), urine (10%)[1] |
| 識別 | |
| CAS番号 |
75330-75-5 |
| ATCコード | C10AA02 (WHO) |
| PubChem | CID: 53232 |
| IUPHAR/BPS | 2739 |
| DrugBank |
DB00227 |
| ChemSpider |
48085 |
| UNII |
9LHU78OQFD |
| KEGG |
D00359 |
| ChEBI |
CHEBI:40303 |
| ChEMBL |
CHEMBL503 |
| 別名 | Monacolin K, Mevinolin |
| 化学的データ | |
| 化学式 | C24H36O5 |
| 分子量 | 404.55 g·mol−1 |
| |
ロバスタチン(モナコリンK、メバコール等とも呼ばれるLovastatin) はスタチン系の薬剤の一種であり、血中コレステロールを低減し[2]、心血管疾患のリスクを低減する作用がある[2]。
一般的な副作用には、下痢、便秘、頭痛、筋肉痛、発疹、睡眠障害などがある。重篤な副作用としては、肝臓障害、筋力低下、腎不全などがある[2]。妊娠中の使用は胎児への有害性の懸念が指摘されており、また授乳中の使用は禁忌とされている[2]。作用機序として、HMG-CoA還元酵素を阻害することにより、肝臓のコレステロール産生能力を低下させることが知られている[2]。
ロバスタチンは1979年に特許を取得し、1987年に医薬品として承認され[3]、世界保健機関(WHO)の必須医薬品リストに掲載されている[4]。日本国内においては未承認である。
医療現場での利用[編集]
ロバスタチンの主な用途は、脂質異常症の治療と心血管疾患の予防である[5][6]。医薬品による治療開始は、食事療法、運動療法、体重減少などの他の治療法でコレステロール値が改善を検討した後に選択する事が推奨されている[6]。
副作用[編集]
ロバスタチンは患者への負荷が少ない医薬品とされるが、最も一般的な副作用は、頻度の高い順に、クレアチンホスホキナーゼ上昇、鼓腸、腹痛、便秘、下痢、筋肉痛、吐き気、消化不良、脱力感、目のかすみ、発疹、めまい、筋痙攣である[7]。他のスタチン系薬剤と同様に、まれにミオパチー、肝毒性(肝障害)、皮膚筋炎、横紋筋融解症を引き起こすことがある。ロバスタチン服用中の原因不明の筋肉痛や筋力低下は、速やかに医師に報告する必要がある。その他、医師または救急医療機関に速やかに報告すべき副作用には以下のものがある[8]:
- 筋肉痛
- 圧痛
- 脱力感
- 発熱
- 濃い色の尿
- 黄疸:皮膚や目の黄変
- 胃の右上の痛み
- 吐き気
- 異常な出血またはあざ
- 食欲不振
- インフルエンザ様症状
- 発疹
- じんましん
- かゆみ
- 呼吸困難または嚥下困難
- 顔、喉、舌、唇、目、手、足、足首、下肢の腫れ
- 嗄声
これらの重篤でない副作用が持続したり、重篤度が増したりした場合も報告する必要がある。
- 便秘
- 記憶喪失または物忘れ
- 錯乱
禁忌事項[編集]
禁忌(ロバスタチンによる治療を差し控えるべき状態)には、妊娠、授乳、肝疾患が含まれる。ロバスタチンは妊娠中は禁忌である(カテゴリーX)。骨格の奇形や学習障害などの先天性障異常を引き起こす可能性がある。乳児の脂質代謝を阻害する可能性があるため、授乳中はロバスタチンを服用すべきではない[9]。肝疾患患者はロバスタチンを服用してはならない[10]。
相互作用[編集]
アトルバスタチン、シンバスタチン、およびCYP3A4を介して代謝される他のスタチン薬と同様に、ロバスタチン治療中にグレープフルーツジュースを飲むと副作用のリスクが高まる可能性がある。グレープフルーツジュースの成分であるフラボノイドのナリンギン、またはフラノクマリンのベルガモチンはin vitroでCYP3A4を阻害し[11]、グレープフルーツジュースの濃縮液がin vivoでロバスタチンの代謝速度を減少させ、血漿中濃度を上昇させる作用があると考えられる[12]。
作用機序[編集]
ロバスタチンは、HMG-CoAからメバロン酸への変換を触媒する酵素であるヒドロキシメチルグルタリル-コエンザイムA還元酵素(HMG-CoA還元酵素)の阻害剤である[13]。メバロン酸はコレステロールの生合成に必要な構成要素であり、ロバスタチンはHMG-CoA還元酵素に結合するHMG-CoAの可逆的競合阻害剤として作用することにより、その生成を阻害する。ロバスタチンはプロドラッグであり、投与されるγ-ラクトン閉環型は生体内で加水分解され、活性型のβ-ヒドロキシ酸開環型となる。
ロバスタチンをはじめとするスタチンは、がんに対する化学療法について研究されてきた[14]。初期の研究ではそのような効果は認められなかった。より最近の研究では、特にスタチンと他の抗癌剤との併用において、ある種のがんに対する治療効果と予防効果が明らかになった[15]。これらの効果は、スタチンがプロテアソーム活性を低下させ、サイクリン依存性キナーゼ阻害剤であるp21とp27の蓄積を引き起こし、G1相の停止を引き起こすという特性によって媒介されている可能性が高いとされている[16][17]。
歴史[編集]

天然物であるコンパクチンとロバスタチンはHMG-CoA還元酵素を強力に阻害する。1970年代に発見され、LDLコレステロールを低下させる可能性のある医薬品として臨床開発された[19][20]。ロバスタチンは1979年に東京農工大学の遠藤により発見され、三共に特許を譲渡している。ほぼ同時期に米メルクもロバスタチンを発見しており、日米で研究が進んだ[21]。
1982年、Aspergillus terreusから単離されたポリケチド由来の天然物であるロバスタチンについて、非常にリスクの高い患者を対象とした小規模な臨床試験が実施され、LDLコレステロールの劇的な低下が観察されたが、副作用はほとんど認められなかった。ロバスタチンを用いた追加の動物実験で、コンパクチンに関連すると考えられるタイプの毒性は認められなかったため、臨床試験が続けられた。
大規模臨床試験でロバスタチンの有効性が確認された。患者への負荷は先行研究と同様に少なく、ロバスタチンは1987年に米国FDAによって承認された。これがFDAによって承認された最初のスタチンであった[22]。
ロバスタチンはまた、Pleurotus ostreatus(ヒラタケ)や近縁のPleurotus属のようなある種の高等真菌によっても天然に生産される[23]。ヒラタケとその抽出物が実験動物のコレステロール値に及ぼす影響に関する研究は広範囲に及んでいる[24][25][26][27][28][29][30][31][32][33][34][35]、しかし、その効果が実際に臨床試験で確認された例は少ない[36]。
1998年、FDAはロバスタチンを含む紅麹由来の栄養補助食品の販売を禁止した[37]。FDAは紅麹には天然のロバスタチンが含まれており、ロバスタチンを含む製品には医薬品の承認が必要であるとした[38]。その後、ユタ州連邦地方裁判所のデイル・A・キンボール判事は、コレスチンの製造元であるファーマネックス社の申し立てを認め、同製品は医薬品ではなく栄養補助食品として販売されているため、1994年の栄養補助食品健康教育法(Dietary Supplement Health and Education Act)に基づき、同局の禁止措置は違法であるとした[39]。
ロバスタチンを処方する目的は、過剰なコレステロール値を正常な身体機能の維持に見合う量まで減少させることである。コレステロールは、25以上の酵素反応によって生合成される。この酵素反応では、まずアセチルCoAが3回連続して縮合し、6個の炭素を持つヒドロキシメチルグルタリルコエンザイムA(HMG-CoA)となる。これがメバロン酸に還元され、一連の反応でステロールの前駆体であるスクアレンの構成要素であるイソプレンに変換され、ラノステロール(メチル化ステロール)に環化し、さらにコレステロールに代謝される。コレステロールの合成を阻害する初期の試みの多くは、ラノステロールとコレステロールの間の生合成経路の後期を阻害する薬剤に帰結した。この経路の主要な律速段階は、HMG-CoAからメバロン酸への変換を触媒するミクロソーム酵素の活性であり、この酵素は数年前から薬理学的介入の主要な標的であると考えられてきた[13]。
HMG-CoA還元酵素は、生合成経路の初期に発現し、コレステロールの形成に関与する最初のステップの一つである。この酵素が阻害されると、水溶性の中間体であるHMG-CoAが蓄積し、より単純な分子に容易に代謝されるようになる。還元酵素が阻害されると、ステロール環を持つ脂質中間体が蓄積することになる。
ロバスタチンは、高コレステロール血症の治療薬として承認された最初のHMG-CoA還元酵素特異的阻害剤である。HMG-CoA還元酵素の強力で特異的な競合的阻害剤を見出そうとする努力の最初の突破口は、1976年に遠藤らがペニシリウム・シトリウム(Penicillium citrium)の培養物から単離された高度に機能化された真菌の代謝物であるメバスタチンの発見を報告したときに起こった。
生合成経路[編集]
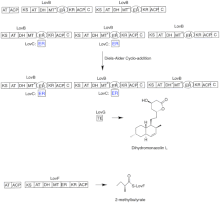

ロバスタチンの生合成は、反復型I型ポリケチド合成酵素(PKS)経路を介して行われる。ロバスタチンの生合成に必須な酵素をコードする遺伝子は、lovB、lovC、lovA、lovD、lovG、lovFの6つである[40][41]。ジヒドロモナコリンLの合成には、9-マロニル-Coaが必要である[42]。PKS経路は(E)のヘキサケチドに達するまで進み、そこでディールス・アルダー反応を起こして縮合環を形成する。環化後、PKS経路を進み、(I)ノナケチドに達し、LovGがコードするチオエステラーゼを介してLovBから遊離される。その後、ジヒドロモナコリンL(J)は、LovAにコードされるシトクロムP450オキシドレダクターゼを介して酸化脱水反応を受け、モナコリンJ(L)を得る。
lovBのMTドメインは、S-アデノシル-L-メチオニン(SAM)からテトラケチド(C)にメチル基を転移する際に、(B)から(C)への変換に活性を示す[43]。LovBは不活性なERドメインを含むため、LovCは完全に還元された生成物を得るために特定の段階で必要とされる。LovB、LovC、LovG、LovFのドメイン構成を図2に示す。lovBの不活性ERドメインは楕円で示し、LovCがLovBに対してトランスで働く場所は赤枠で示した。
並行する反応系では、ロバスタチンのジケチド側鎖はLovFにコードされる別の高還元性I型ポリケチド合成酵素によって合成される。最後に、側鎖の2-メチル酪酸(M)がLovDによってコードされるトランスステラーゼによってモナコリンJ(L)のC-8ヒドロキシ基に共有結合してロバスタチンとなる。
化学合成経路[編集]
ロバスタチンの合成における主要な研究の大部分は、1980年代に平間によって行われた[44][45]。平間はコンパクチンを合成し、その中間体の一つを使って別の経路をたどってロバスタチンに到達した。合成順序は以下のスキームに示されている。γ-ラクトンはグルタミン酸から出発し、山田式合成法を用いて合成した。メタノール中でリチウムメトキシドを用いてラクトン開環を行い、次にシリル化を行って出発ラクトンとシリルエーテルの分離可能な混合物を得た。シリルエーテルの水素化分解とコリンズ酸化によりアルデヒドが得られた。(E,E)-1,5-ジエンの立体選択的調製は、トランス-クロチルフェニルスルホンアニオンの添加、Ac2Oによるクエンチ、フェニルスルホンアニオンの還元的除去によって達成された。これをジメチルメチルホスホン酸のリチウムアニオンと縮合させると化合物1が得られた。化合物2は合成手順のスキームに示すように合成した。次に、化合物1と2を、THF中1.3eqの水素化ナトリウムを用い、次いでクロロベンゼン中、窒素下で82時間還流し、エノン3を得た。
ロバスタチンを得るために、スキームに示すような簡単な有機反応が用いられた。
社会と文化[編集]
天然資源[編集]
ロバスタチンは、天然に存在する化合物で、ヒラタケ[46]、紅麹[47]、プーアル茶[48]などの食品に低濃度で含まれている。
製品名[編集]
Mevacor、 Advicor (ナイアシンを含む)、 Altocor、 Altoprev
植物生理学では、ロバスタチンはサイトカイニン生合成阻害剤として使用されることもある[49]。
脚注[編集]
- ^ a b c d e “Pharmacokinetic comparison of the potential over-the-counter statins simvastatin, lovastatin, fluvastatin and pravastatin”. Clinical Pharmacokinetics 47 (7): 463–474. (2008). doi:10.2165/00003088-200847070-00003. PMID 18563955.
- ^ a b c d e “Drugbank:Lovastatin”. 2024年3月27日閲覧。
- ^ Analogue-based Drug Discovery. John Wiley & Sons. (2006). p. 472. ISBN 9783527607495
- ^ “WHO:Lovastatin”. 2024年3月27日閲覧。
- ^ “Drugbank:Lovastatin”. 2024年3月27日閲覧。
- ^ a b “Lovastatin”. The American Society of Health-System Pharmacists. 2011年4月3日閲覧。
- ^ “Mevacor, Altoprev (lovastatin) dosing, indications, interactions, adverse effects, and more”. Medscape Reference. WebMD. 2014年3月17日閲覧。
- ^ “Lovastatin”. MedlinePlus. U.S. National Library of Medicine (2012年6月15日). 2012年12月1日閲覧。
- ^ “Lovastatin”. LactMed. U.S. National Library of Medicine. 2012年12月1日閲覧。
- ^ “Mevacor Side Effects Center”. RxList. 2012年12月1日閲覧。
- ^ “Grapefruit juice-drug interactions”. British Journal of Clinical Pharmacology 46 (2): 101–110. (August 1998). doi:10.1046/j.1365-2125.1998.00764.x. PMC 1873672. PMID 9723817.
- ^ “Grapefruit juice greatly increases serum concentrations of lovastatin and lovastatin acid”. Clinical Pharmacology and Therapeutics 63 (4): 397–402. (April 1998). doi:10.1016/S0009-9236(98)90034-0. PMID 9585793.
- ^ a b “Discovery, biochemistry and biology of lovastatin”. The American Journal of Cardiology 62 (15): 10J–15J. (November 1988). doi:10.1016/0002-9149(88)90002-1. PMID 3055919.
- ^ “Therapy insight: Potential of statins for cancer chemoprevention and therapy”. Nature Clinical Practice. Oncology 2 (2): 82–89. (February 2005). doi:10.1038/ncponc0097. PMID 16264880.
- ^ “Statins as anti-cancer therapy; Can we translate preclinical and epidemiologic data into clinical benefit?”. Discovery Medicine 20 (112): 413–427. (December 2015). PMID 26760985.
- ^ “Cell cycle-specific effects of lovastatin”. Proceedings of the National Academy of Sciences of the United States of America 88 (9): 3628–3632. (May 1991). Bibcode: 1991PNAS...88.3628J. doi:10.1073/pnas.88.9.3628. PMC 51505. PMID 1673788.
- ^ “Lovastatin-mediated G1 arrest is through inhibition of the proteasome, independent of hydroxymethyl glutaryl-CoA reductase”. Proceedings of the National Academy of Sciences of the United States of America 96 (14): 7797–7802. (July 1999). Bibcode: 1999PNAS...96.7797R. doi:10.1073/pnas.96.14.7797. PMC 22141. PMID 10393901.
- ^ “Production and purification of statins from Pleurotus ostreatus (Basidiomycetes) strains”. Zeitschrift für Naturforschung C 58 (1–2): 62–64. (Jan–Feb 2003). doi:10.1515/znc-2003-1-211. PMID 12622228.
- ^ “Biosynthesis of the hypocholesterolemic agent mevinolin by Aspergillus terreus. Determination of the origin of carbon, hydrogen and oxygen by 13C NMR and mass spectrometry”. J Am Chem Soc 107 (12): 3694–701. (1985). doi:10.1021/ja00298a046.
- ^ “Mevinolin: a highly potent competitive inhibitor of hydroxymethylglutaryl-coenzyme A reductase and a cholesterol-lowering agent”. Proceedings of the National Academy of Sciences of the United States of America 77 (7): 3957–3961. (July 1980). Bibcode: 1980PNAS...77.3957A. doi:10.1073/pnas.77.7.3957. PMC 349746. PMID 6933445.
- ^ “平成の30年間に世界で一番使われた薬【平成の医療史30年◆スタチン編】”. 2024年3月27日閲覧。
- ^ “The origin of the statins. 2004”. Atherosclerosis. Supplements 5 (3): 125–130. (October 2004). doi:10.1016/j.atherosclerosissup.2004.08.033. PMID 15531285.
- ^ “Dose- and time-dependent hypocholesterolemic effect of oyster mushroom (Pleurotus ostreatus) in rats”. Nutrition 14 (3): 282–286. (March 1998). doi:10.1016/S0899-9007(97)00471-1. PMID 9583372.
- ^ “Dietary mushroom (Pleurotus ostreatus) ameliorates atherogenic lipid in hypercholesterolaemic rats”. Clinical and Experimental Pharmacology & Physiology 30 (7): 470–475. (July 2003). doi:10.1046/j.1440-1681.2003.03857.x. PMID 12823261.
- ^ “Hypocholesterolemic and antiatherogenic effect of oyster mushroom (Pleurotus ostreatus) in rabbits”. Die Nahrung 43 (5): 339–342. (October 1999). doi:10.1002/(SICI)1521-3803(19991001)43:5<339::AID-FOOD339>3.0.CO;2-5. PMID 10555301.
- ^ “Dose- and time-dependent hypocholesterolemic effect of oyster mushroom (Pleurotus ostreatus) in rats”. Nutrition 14 (3): 282–286. (March 1998). doi:10.1016/S0899-9007(97)00471-1. PMID 9583372.
- ^ “Evidence for the anti-hyperlipidaemic activity of the edible fungus Pleurotus ostreatus”. British Journal of Biomedical Science 54 (4): 240–243. (December 1997). PMID 9624732.
- ^ “Role of oyster mushroom (Pleurotus florida) as hypocholesterolemic/antiatherogenic agent”. Indian Journal of Experimental Biology 35 (10): 1070–1075. (October 1997). PMID 9475042.
- ^ “[Regulation of cholesterol metabolism with dietary addition of oyster mushrooms (Pleurotus ostreatus) in rats with hypercholesterolemia]” (スロバキア語). Casopis Lekaru Ceskych 136 (6): 186–190. (March 1997). PMID 9221192.
- ^ “Effect of oyster mushroom (Pleurotus Ostreatus) and its ethanolic extract in diet on absorption and turnover of cholesterol in hypercholesterolemic rat”. Die Nahrung 40 (4): 222–224. (August 1996). doi:10.1002/food.19960400413. PMID 8810086.
- ^ “Dietary oyster mushroom (Pleurotus ostreatus) accelerates plasma cholesterol turnover in hypercholesterolaemic rat”. Physiological Research 44 (5): 287–291. (1995). PMID 8869262.
- ^ “The effect of oyster mushroom (Pleurotus ostreatus), its ethanolic extract and extraction residues on cholesterol levels in serum, lipoproteins and liver of rat”. Die Nahrung 39 (1): 98–99. (1995). doi:10.1002/food.19950390113. PMID 7898579.
- ^ “Mechanism of hypocholesterolemic effect of oyster mushroom (Pleurotus ostreatus) in rats: reduction of cholesterol absorption and increase of plasma cholesterol removal”. Zeitschrift für Ernährungswissenschaft 33 (1): 44–50. (March 1994). doi:10.1007/BF01610577. PMID 8197787.
- ^ “Effect of the oyster fungus on glycaemia and cholesterolaemia in rats with insulin-dependent diabetes”. Physiological Research 42 (3): 175–179. (1993). PMID 8218150.
- ^ “Cholesterol-lowering effect of the mushroom Pleurotus ostreatus in hereditary hypercholesterolemic rats”. Annals of Nutrition & Metabolism 35 (4): 191–195. (1991). doi:10.1159/000177644. PMID 1897899.
- ^ “Oyster mushroom reduced blood glucose and cholesterol in diabetic subjects”. Mymensingh Medical Journal 16 (1): 94–99. (January 2007). doi:10.3329/mmj.v16i1.261. PMID 17344789.
- ^ “FDA bans red yeast rice product”. The Lancet 351 (9116): 1637. (1998). doi:10.1016/s0140-6736(05)77698-4.
- ^ “FDA bans red yeast rice product”. The Lancet 351 (9116): 1637. (1998). doi:10.1016/s0140-6736(05)77698-4.
- ^ Cholesterol Treatment Upheld, The New York Times, 18 February 1999
- ^ “Biosynthesis of lovastatin and related metabolites formed by fungal iterative PKS enzymes”. Biopolymers 93 (9): 755–763. (September 2010). doi:10.1002/bip.21428. PMID 20577995.
- ^ “LovG: the thioesterase required for dihydromonacolin L release and lovastatin nonaketide synthase turnover in lovastatin biosynthesis”. Angewandte Chemie 52 (25): 6472–6475. (June 2013). doi:10.1002/anie.201302406. PMC 3844545. PMID 23653178.
- ^ “Biosynthesis of lovastatin and related metabolites formed by fungal iterative PKS enzymes”. Biopolymers 93 (9): 755–763. (September 2010). doi:10.1002/bip.21428. PMID 20577995.
- ^ “Biosynthesis of lovastatin and related metabolites formed by fungal iterative PKS enzymes”. Biopolymers 93 (9): 755–763. (September 2010). doi:10.1002/bip.21428. PMID 20577995.
- ^ “A chiral total synthesis of compactin”. J. Am. Chem. Soc. 104 (15): 4251–4253. (1982). doi:10.1021/ja00379a037.
- ^ “Synthesis of (+)-Mevinolin starting from Naturally occurring building blocks and using an asymmetry inducing reaction”. Tetrahedron Lett. 24 (17): 1811–1812. (1983). doi:10.1016/S0040-4039(00)81777-3.
- ^ “Pleurotus fruiting bodies contain the inhibitor of 3-hydroxy-3-methylglutaryl-coenzyme A reductase-lovastatin”. Experimental Mycology 19 (1): 1–6. (March 1995). doi:10.1006/emyc.1995.1001. PMID 7614366.
- ^ “Chinese red yeast rice (Monascus purpureus) for primary hyperlipidemia: a meta-analysis of randomized controlled trials”. Chinese Medicine 1 (1): 4. (November 2006). doi:10.1186/1749-8546-1-4. PMC 1761143. PMID 17302963.
- ^ “Exposure assessment of lovastatin in Pu-erh tea”. International Journal of Food Microbiology 164 (1): 26–31. (June 2013). doi:10.1016/j.ijfoodmicro.2013.03.018. PMID 23587710.
- ^ “Assessment of lovastatin application as tool in probing cytokinin-mediated cell cycle regulation”. Physiologia Plantarum 125 (2): 260–267. (2005). doi:10.1111/j.1399-3054.2005.00556.x.






