モルフォリノ

モルフォリノ(英: Morpholino)、モルフォリノアンチセンスオリゴ(英: Morpholino Antisense Oligo)、ホスホロジアミデートモルフォリノオリゴ核酸(英: phosphorodiamidate Morpholino oligomer:PMO)は、分子生物学において遺伝子発現に変化をもたらすために用いられるオリゴヌクレオチド(通称:オリゴ)の一種である。モルフォリノは、核酸塩基が結合したメチレンモルホリン環骨格がホスホロジアミダート基を介して連結された分子構造を持つ。モルフォリノはRNA上の短い特定の配列(約25塩基)と塩基対を形成し、その他の分子のアクセスを遮断する。モルフォリノは、遺伝子の機能をノックダウンする逆遺伝学の研究ツールとして利用されている。
本項目では、核酸アナログであるモルフォリノアンチセンスオリゴについて議論する。「モルフォリノ」または「モルホリノ」という語は、六員環であるモルホリン環を含む化学物質を指す名称にも使われる。他のモルホリン含有分子との混同を避けるため、オリゴとしてのモルフォリノについて記載する場合には英語では"Morpholino"と商標名として大文字で表記されることが多いが、科学文献において統一されているわけではない。モルフォリノはPMOと書かれることもあり、こうした使用例は特に医学文献で多い。細胞内への移行を促進する化学基が共有結合的に付加された、Vivo-MorpholinoやPPMO(peptide-conjugated PMO)といった改良型のモルフォリノも開発されている。
遺伝子ノックダウンは、細胞内の特定の遺伝子の発現を低下させることによって行われる。タンパク質をコードする遺伝子の場合には、通常は対応するタンパク質の細胞内の量の減少が引き起こされる。遺伝子ノックダウンは特定のタンパク質の機能を明らかにする手法の1つである。また同様の手法を用いてRNA転写産物の特定のエクソンのスプライシング除去を引き起こすことで、そのエクソンにコードされるタンパク質領域の機能を明らかにできる場合があるが、タンパク質活性全体のノックダウンが引き起される場合もある。モルフォリノは、マウス、ゼブラフィッシュ、カエル、ウニなど、いくつかのモデル生物での研究に応用されている[1]。モルフォリノはpre-mRNAのスプライシングの変化を引き起こしたり[2]、miRNAの成熟過程や活性を阻害したりすることもできる[3]。モルフォリノによるRNA標的化技術や細胞内への送達技術に関しては、いくつかの総説が書かれている[4][5]。
モルフォリノは、細菌性疾患[6]、ウイルス性疾患[7]や遺伝子疾患[8]を標的として、製薬企業での開発が進められている。サレプタ・セラピューティクスによって開発されたモルフォリノベースの薬剤であるエテプリルセンは、デュシェンヌ型筋ジストロフィーの一部の原因変異に対する治療として2016年9月にアメリカ食品医薬品局(FDA)の迅速承認を受けた[9]。2019年から2021年にかけて、その他のモルフォリノベースの薬剤としてゴロディルセン、ビルトラルセン、カシメルセン(いずれもデュシェンヌ型筋ジストロフィーに対して)がFDAの承認を受けた[10][11][12]。
歴史[編集]
モルフォリノはAntiVirals Inc.(現:サレプタ・セラピューティクス)のJames E. Summertonによって考案され、当初Dwight Wellerと共に開発が行われた[13]。
構造[編集]
モルフォリノは、天然の核酸構造をもとにした再設計によって作製された合成分子である[14]。通常は長さは25塩基であり、相補的配列を持つRNAまたは一本鎖DNAに対して標準的な塩基対形成によって結合する。構造面でのモルフォリノとDNAの差異は、モルフォリノは標準的な核酸塩基を持つが、塩基はメチレンモルホリン環に結合しており、リン酸基ではなくホスホロジアミダート基を介して連結されている[14]。アニオン性のリン酸が電荷を持たないホスホロジアミダートで置換されていることにより、通常の生理的なpHの範囲でのイオン化が起こらず、生体や細胞内でモルフォリノは非荷電分子として振る舞う。モルフォリノ骨格全体がこうした改変サブユニットから構成されている。
機能[編集]
多くのアンチセンス構造種(ホスホロチオエート、siRNAなど)とは異なり、モルフォリノは標的RNA分子の分解を誘導することはない。その代わり、モルフォリノはRNA内の標的配列に結合し、RNAと相互作用する可能性のある他の分子を阻害する(steric blocking)ことで作用する[15]。モルフォリノは、胚中の特定のmRNA転写産物の役割の研究に多く用いられる。ゼブラフィッシュ[16]、アフリカツメガエル[17]、ウニ[18]、卵生メダカの卵や胚への注入によってモルファントを作製したり、ニワトリ胚に対してより発生後期の段階でのエレクトロポレーションによる導入を行うこともできる[19]。細胞質基質への適切な送達システムを用いることで、モルフォリノは培養細胞に対しても有効となる[20][21]。オリゴが送達のためのデンドリマーに共有結合的に連結されたVivo-Morpholinoは、全身投与によって成体動物や培養組織の細胞内へ移行することができる[22]。
真核生物における正常な遺伝子発現[編集]
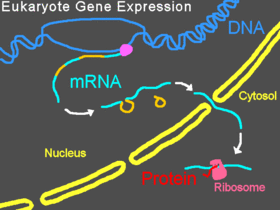
真核生物では、核内でpre-mRNAが転写され、イントロンがスプライシングによって除去され、そして成熟したmRNAが核から細胞質へ搬出される。リボソームの小サブユニットは通常mRNAの5'末端に結合し、そこで他のさまざまな翻訳開始因子と結合して開始複合体を形成する。開始複合体はmRNA上をスキャニングして開始コドンに到達し、そこで大サブユニットが小サブユニットに結合してタンパク質の翻訳が開始される。この過程全体が遺伝子発現と呼ばれ、DNAの塩基配列としてコードされた遺伝子の情報がタンパク質構造へと変換される。モルフォリノはその塩基配列によって、スプライシングの変化や翻訳の遮断、もしくはRNA上のその他の機能的部位の遮断を行う場合がある。
翻訳の遮断[編集]

mRNAの5' UTRにモルフォリノが結合した場合、開始複合体が5'キャップから開始コドンへ移動する過程の妨げとなり、標的転写産物のコーディング領域の翻訳が阻害される(遺伝子発現の「ノックダウン」と呼ばれる)。このようにモルフォリノは特定のタンパク質の機能を明らかにするための有用な実験ツールであり、タンパク質の発現をノックダウンし、その結果生じる細胞や個体の変化を知るための簡便な手法となる。モルフォリノによる発現のノックダウンは非常に強い効果を示す場合があり、既存の標的タンパク質が分解された後にはウエスタンブロットでも検出されなくなる場合がある。
2016年には、PPMOによるニューデリー・メタロ-β-ラクタマーゼ(多くの薬剤耐性菌がカルバペネム分解に利用する酵素)の発現阻害が報告されている[23][24]。
pre-mRNAスプライシングの変化[編集]

モルフォリノは、スプライシング部位を検知するsnRNP複合体による標的pre-mRNAのイントロン境界への結合を防ぐ、求核性のアデニン塩基を遮断してラリアット構造の形成を防ぐ、スプライシングサイレンサー[25]やエンハンサー[26]に対するスプライシング調節タンパク質の結合に干渉する、といった方法のいずれかによって、pre-mRNAのプロセシング過程を妨げることができる。U1 snRNP(供与部位へ結合する)もしくはU2/U5 snRNP(ポリピリミジン領域と受容部位へ結合する)の結合を防ぐことでスプライシングに変化が生じ、一般的には成熟mRNAから特定のエクソンが除去される。一部のスプライス部位を標的とした場合にはイントロンが組み込まれることや、通常用いられない隠れた(cryptic)スプライシング部位が活性化されて部分的な組み込みや除去が引き起こされることもある[27]。また、U11/U12 snRNPの標的も遮断することができる[28]。スプライシングの変化はRT-PCRによって簡単にアッセイを行うことができ、RT-PCR産物のゲル電気泳動後のバンドシフトを観察することで判別することができる[2]。
その他の用途:その他のmRNA部位の遮断、プローブとしての利用[編集]
モルフォリノは、miRNAの活性[29][30]や成熟[3]の遮断にも利用される。フルオレセインが付加されたモルフォリノは、フルオレセイン特異的抗体と併用することでmiRNAのin situハイブリダイゼーションのプローブとして利用することができる[31]。また、リボザイムの活性の遮断や[32]、U2 snRNP、U12 snRNPの機能を全体的に阻害することもできる[33]。mRNAのタンパク質コード領域内の滑りやすい(slippery)配列を標的としたモルフォリノは、翻訳のフレームシフトを引き起こす[34]。モルフォリノは、RNA編集[35]、ポリAテール形成[36]、mRNA局在化[37]といった過程を遮断することもできる。こうしたさまざまな標的に対してモルフォリノが活性を有することは、タンパク質またはmRNA内の核酸の相互作用を遮断するための汎用ツールとして利用可能であることを示唆している。
特異性、安定性、アンチセンス以外の効果[編集]
モルフォリノは、動物の胚を用いる系における標準的なノックダウンのツールとなっている。胚は成体細胞よりも遺伝子発現の幅が広く、オフターゲット相互作用の強い影響を受ける場合がある。カエルまたは魚類の一細胞期もしくは数細胞期の胚への注入後、器官形成と分化のほとんどの過程が経過する、最大5日後までモルフォリノの効果は測定することができる[38]。通常、無関係な配列のオリゴをコントールとして用い、こうしたオリゴは胚の表現型に変化をもたらすことはないが、モルフォリノの効果の配列特異性、そしてアンチセンスオリゴとしての効果以外の影響ではないことの証拠となる。同じmRNAを標的とする何種類かのモルフォリノを同時注入することでノックダウンに必要な用量を減らすことができ、用量依存的なオフターゲットRNA相互作用の低減または除去のための有効な戦略となる[39]。
また、mRNAによるレスキュー実験によって野生型の表現型が回復することがあり、このこともモルフォリノの特異性を示すための証拠となる。mRNAレスキュー実験では、標的となるタンパク質をコードするmRNAの共注入を行う。レスキューのためのmRNAにはモルフォリノの標的となる配列が存在しないよう改変を行っておくことで、レスキューmRNAはモルフォリノ存在下でも目的タンパク質を発現することができるようになる。レスキューmRNAはモルフォリノの影響を受けないため、共注入によって表現型が回復することはモルフォリノの特異性を示すさらなる証拠となる[38]。一部のケースでは、レスキューmRNAの異所性発現のため、野生型表現型のレスキューが不可能となる場合もある。
モルフォリノによる予期していないRNA相互作用の影響を確認するためにヌル変異体の胚で試験を行い、その後に野生型の胚を用いて急激なノックダウンによる表現型を明らかにすることも行われる。ノックダウンによる表現型は変異体の表現型よりも強力であることが多いが、それは変異体ではヌル遺伝子に対して遺伝的な補償作用がはたらく場合があるためである[40]。
モルフォリノは非天然型の骨格を持つため、細胞のタンパク質によって認識されない。ヌクレアーゼはモルフォリノを分解せず[41]、モルフォリノは血清中や細胞内でも分解されない[42]。
ゼブラフィッシュでは最大で18%のモルフォリノで、胚の中枢神経系や体節組織において細胞死など標的と無関係な表現型が誘導されるようである[43]。こうした効果の大部分はp53を介したアポトーシスの活性化によるものであり、標的に対するモルフォリノと抗p53モルフォリノを共注入することで抑制することができる。モルフォリノを用いたノックダウンによるp53を介したアポトーシス効果は他の構造種のアンチセンスオリゴを用いた場合も同様の表現型が出現し、オリゴの種類によるものではない[44]。
モルファントの表現型が意図したノックダウンによるものであるのか、それともオフターゲットRNAとの相互作用によるものであるのかは、同じmRNAの重複しない配列を標的とした別のモルフォリノを用いる[38]、観察された表現型を変異体のものと比較する(ただし一部の変異体では保証効果によって表現型があいまいになる場合がある)、ヌル変異体に対してモルフォリノによってさらなる表現型的変化が生じるかを試す、ドミナントネガティブ変異体を用いるといった、他の実験によって確認が行われる。上述したように、レスキューmRNAの共注入による観察された表現型のレスキューが可能であれば、モルフォリノ特異性を示すための信頼性の高い試験となる[38][40]。
送達[編集]
モルフォリノが効果を発揮するためには、細胞膜を通過して細胞質基質へ送達される必要がある。細胞質基質へのマイクロインジェクション後に核内でのスプライシングへの影響が示されているように、細胞質基質に到達したモルフォリノは細胞質と核の間を自由に拡散する。胚、培養細胞、成体への送達にはそれぞれ異なる手法が用いられている。胚への送達には通常はマイクロインジェクション装置が用いられ、注入は一細胞期または数細胞期に行われるのが最も一般的である[45]。胚への送達の他の手法としてはエレクトロポレーションがあり、胚発生のより後期の段階の組織へオリゴを送達することができる[46]。培養細胞への送達の一般的な手法としては、Endo-Porterペプチド(モルフォリノがエンドソームから放出される)[21]、Special Delivery system(現在市販されていない。モルフォリノ-DNAヘテロ二本鎖とエトキシ化ポリエチレンイミン送達試薬を用いる)[20]、エレクトロポレーション[47]、scrape loading[48]などがある。
成体組織への送達は通常は困難であるが、未修飾のモルフォリノの取り込みを可能にするいくつかのシステムが存在する(デュシェンヌ型筋ジストロフィーの筋細胞への取り込み[49]やバルーン血管形成術中のストレス下の血管内皮細胞への取り込み[50]など)。モルフォリノは組織内の細胞間空間を介して浸透するが、未修飾モルフォリノの静脈内投与後の健康な組織の細胞質基質や核への分布は限定的である。成体の多くの細胞への全身投与はモルフォリノに対する細胞透過ペプチドの共有結合修飾によって可能となり、こうしたペプチドコンジュゲートは中用量で毒性を示すものの[51][52]、こうした毒性が観察される用量以下でin vivoでの効果的な送達に利用されている[7][53]。また、モルフォリノの末端にオクタグアニジンデンドリマーを付加することで、この修飾オリゴ(Vivo-Morpholinoと呼ばれる)を血中から細胞質基質へ送達することができるようになる[22][54]。ペプチドコンジュゲートやVivo-Morpholinoなど、送達を可能にしたモルフォリノはウイルス性疾患や遺伝子疾患に対する治療薬としての有望性を示している[55]。
出典[編集]
- ^ “Morpholino oligos: making sense of antisense?”. Developmental Biology 243 (2): 209–14. (March 2002). doi:10.1006/dbio.2001.0565. PMID 11884031.
- ^ a b “Inhibition of zebrafish fgf8 pre-mRNA splicing with morpholino oligos: a quantifiable method for gene knockdown”. Genesis 30 (3): 154–6. (July 2001). doi:10.1002/gene.1053. PMID 11477696.
- ^ a b “Targeted inhibition of miRNA maturation with morpholinos reveals a role for miR-375 in pancreatic islet development”. PLOS Biology 5 (8): e203. (August 2007). doi:10.1371/journal.pbio.0050203. PMC 1925136. PMID 17676975.
- ^ “Guide for Morpholino Users: Toward Therapeutics”. J Drug Discov Develop and Deliv 3 (2): 1023. (2016).
- ^ (英語) Morpholino Oligomers. Methods in Molecular Biology. 1565. Humana Press (Springer). (2017). pp. 284. doi:10.1007/978-1-4939-6817-6. ISBN 978-1-4939-6815-2
- ^ “Antibacterial antisense”. Current Opinion in Molecular Therapeutics 7 (2): 109–13. (April 2005). PMID 15844617.
- ^ a b “In vitro resistance selection and in vivo efficacy of morpholino oligomers against West Nile virus”. Antimicrobial Agents and Chemotherapy 51 (7): 2470–82. (July 2007). doi:10.1128/AAC.00069-07. PMC 1913242. PMID 17485503.
- ^ “Induced dystrophin exon skipping in human muscle explants”. Neuromuscular Disorders 16 (9–10): 583–90. (October 2006). doi:10.1016/j.nmd.2006.05.017. PMID 16919955.
- ^ “Press Announcements - FDA grants accelerated approval to first drug for Duchenne muscular dystrophy”. Food and Drug Administration (2019年9月10日). 2023年10月7日閲覧。
- ^ Commissioner, Office of the (2019年12月12日). “FDA grants accelerated approval to first targeted treatment for rare Duchenne muscular dystrophy mutation” (英語). FDA. 2019年12月14日閲覧。
- ^ Roshmi, R. R.; Yokota, T. (October 2019). “Viltolarsen for the treatment of Duchenne muscular dystrophy”. Drugs of Today 55 (10): 627–639. doi:10.1358/dot.2019.55.10.3045038. ISSN 1699-3993. PMID 31720560.
- ^ Shirley, Matt (May 2021). “Casimersen: First Approval”. Drugs 81 (7): 875–879. doi:10.1007/s40265-021-01512-2. ISSN 1179-1950. PMID 33861387.
- ^ “Invention and Early History of Morpholinos: From Pipe Dream to Practical Products” (英語). Morpholino Oligomers. Methods in Molecular Biology. 1565. Humana Press (Springer). (2017). pp. 1–15. doi:10.1007/978-1-4939-6817-6_1. ISBN 978-1-4939-6817-6. PMID 28364229
- ^ a b “Morpholino antisense oligomers: design, preparation, and properties”. Antisense & Nucleic Acid Drug Development 7 (3): 187–95. (June 1997). doi:10.1089/oli.1.1997.7.187. PMID 9212909.
- ^ “Morpholino antisense oligomers: the case for an RNase H-independent structural type”. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression 1489 (1): 141–58. (December 1999). doi:10.1016/S0167-4781(99)00150-5. PMID 10807004.
- ^ “Effective targeted gene 'knockdown' in zebrafish”. Nature Genetics 26 (2): 216–20. (October 2000). doi:10.1038/79951. PMID 11017081.
- ^ “Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach”. Developmental Biology 222 (1): 124–34. (June 2000). doi:10.1006/dbio.2000.9720. PMID 10885751.
- ^ “SpKrl: a direct target of beta-catenin regulation required for endoderm differentiation in sea urchin embryos”. Development 128 (3): 365–75. (February 2001). doi:10.1242/dev.128.3.365. PMID 11152635.
- ^ “The winged-helix transcription factor FoxD3 is important for establishing the neural crest lineage and repressing melanogenesis in avian embryos”. Development 128 (8): 1467–79. (April 2001). doi:10.1242/dev.128.8.1467. PMID 11262245.
- ^ a b “Achieving efficient delivery of morpholino oligos in cultured cells”. Genesis 30 (3): 94–102. (July 2001). doi:10.1002/gene.1039. PMID 11477682.
- ^ a b “Endo-Porter: a novel reagent for safe, effective delivery of substances into cells”. Annals of the New York Academy of Sciences 1058 (1): 62–75. (November 2005). Bibcode: 2005NYASA1058...62S. doi:10.1196/annals.1359.012. PMID 16394126.
- ^ a b “Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues”. BioTechniques 45 (6): 613–4, 616, 618 passim. (December 2008). doi:10.2144/000113005. PMID 19238792.
- ^ “New molecule knocks out superbugs' immunity to antibiotics”. newatlas.com (2017年1月20日). 2017年1月25日閲覧。
- ^ “Peptide-conjugated phosphorodiamidate morpholino oligomer (PPMO) restores carbapenem susceptibility to NDM-1-positive pathogens in vitro and in vivo”. The Journal of Antimicrobial Chemotherapy 72 (3): 782–790. (March 2017). doi:10.1093/jac/dkw476. PMC 5890718. PMID 27999041.
- ^ “Correction of aberrant FGFR1 alternative RNA splicing through targeting of intronic regulatory elements”. Human Molecular Genetics 13 (20): 2409–20. (October 2004). doi:10.1093/hmg/ddh272. PMID 15333583.
- ^ “Aberrant splicing in the ocular albinism type 1 gene (OA1/GPR143) is corrected in vitro by morpholino antisense oligonucleotides”. Human Mutation 27 (5): 420–6. (May 2006). doi:10.1002/humu.20303. PMID 16550551.
- ^ “Achieving targeted and quantifiable alteration of mRNA splicing with Morpholino oligos”. Biochemical and Biophysical Research Communications 358 (2): 521–7. (June 2007). doi:10.1016/j.bbrc.2007.04.172. PMID 17493584.
- ^ “Splicing segregation: the minor spliceosome acts outside the nucleus and controls cell proliferation”. Cell 131 (4): 718–29. (November 2007). doi:10.1016/j.cell.2007.09.043. PMID 18022366.
- ^ “Substrate requirements for let-7 function in the developing zebrafish embryo”. Nucleic Acids Research 32 (21): 6284–91. (2004). doi:10.1093/nar/gkh968. PMC 535676. PMID 15585662.
- ^ “Zebrafish miR-214 modulates Hedgehog signaling to specify muscle cell fate”. Nature Genetics 39 (2): 259–63. (February 2007). doi:10.1038/ng1953. PMC 3982799. PMID 17220889.
- ^ “Revealing details: whole mount microRNA in situ hybridization protocol for zebrafish embryos and adult tissues”. Biology Open 1 (6): 566–9. (June 2012). doi:10.1242/bio.2012810. PMC 3509442. PMID 23213449.
- ^ “Exogenous control of mammalian gene expression through modulation of RNA self-cleavage”. Nature 431 (7007): 471–6. (September 2004). Bibcode: 2004Natur.431..471Y. doi:10.1038/nature02844. PMID 15386015.
- ^ “Targeted 'knockdown' of spliceosome function in mammalian cells”. Nucleic Acids Research 33 (4): e41. (February 2005). doi:10.1093/nar/gni041. PMC 549580. PMID 15731334.
- ^ “Efficient stimulation of site-specific ribosome frameshifting by antisense oligonucleotides”. RNA 10 (10): 1653–61. (October 2004). doi:10.1261/rna.7810204. PMC 1370650. PMID 15383681.
- ^ “Steric antisense inhibition of AMPA receptor Q/R editing reveals tight coupling to intronic editing sites and splicing”. Nucleic Acids Research 41 (2): 1113–23. (January 2013). doi:10.1093/nar/gks1044. PMC 3553965. PMID 23172291.
- ^ “Induction of antagonistic soluble decoy receptor tyrosine kinases by intronic polyA activation”. Molecular Cell 43 (6): 927–39. (September 2011). doi:10.1016/j.molcel.2011.08.009. PMC 3781938. PMID 21925381.
- ^ “Participation of Xenopus Elr-type proteins in vegetal mRNA localization during oogenesis”. The Journal of Biological Chemistry 284 (30): 19982–92. (July 2009). doi:10.1074/jbc.M109.009928. PMC 2740424. PMID 19458392.
- ^ a b c d “A primer for morpholino use in zebrafish”. Zebrafish 6 (1): 69–77. (March 2009). doi:10.1089/zeb.2008.0555. PMC 2776066. PMID 19374550.
- ^ “Quantitative assessment of the knockdown efficiency of morpholino antisense oligonucleotides in zebrafish embryos using a luciferase assay”. Genesis 46 (1): 1–7. (January 2008). doi:10.1002/dvg.20361. PMID 18196596.
- ^ a b “Guidelines for morpholino use in zebrafish”. PLOS Genetics 13 (10): e1007000. (October 2017). doi:10.1371/journal.pgen.1007000. PMC 5648102. PMID 29049395.
- ^ “Resistance of morpholino phosphorodiamidate oligomers to enzymatic degradation”. Antisense & Nucleic Acid Drug Development 6 (4): 267–72. (1996). doi:10.1089/oli.1.1996.6.267. PMID 9012862.
- ^ “Stability of cell-penetrating peptide-morpholino oligomer conjugates in human serum and in cells”. Bioconjugate Chemistry 18 (1): 50–60. (2007). doi:10.1021/bc060138s. PMID 17226957.
- ^ “Morphant technology in model developmental systems”. Genesis 30 (3): 89–93. (July 2001). doi:10.1002/gene.1038. PMID 11477681.
- ^ “p53 activation by knockdown technologies”. PLOS Genetics 3 (5): e78. (May 2007). doi:10.1371/journal.pgen.0030078. PMC 1877875. PMID 17530925.
- ^ “Microinjection of zebrafish embryos to analyze gene function”. Journal of Visualized Experiments 9 (25). (March 2009). doi:10.3791/1115. PMC 2762901. PMID 19274045.
- ^ “Electroporation of DNA, RNA, and morpholinos into zebrafish embryos”. Methods 39 (3): 207–11. (July 2006). doi:10.1016/j.ymeth.2005.12.009. hdl:10533/178089. PMID 16837210.
- ^ “Optimizing electroporation conditions for intracellular delivery of Morpholino antisense oligonucleotides directed against the hepatitis C virus internal ribosome entry site”. Antisense Therapeutics. 106. (2004). 309–22. doi:10.1385/1-59259-854-4:309. ISBN 978-1-59259-854-0. PMID 15375324
- ^ “A simple method for delivering morpholino antisense oligos into the cytoplasm of cells”. Antisense & Nucleic Acid Drug Development 6 (3): 169–75. (1996). doi:10.1089/oli.1.1996.6.169. PMID 8915501.
- ^ “Dystrophin expression in the mdx mouse after localised and systemic administration of a morpholino antisense oligonucleotide”. The Journal of Gene Medicine 8 (2): 207–16. (February 2006). doi:10.1002/jgm.838. PMID 16285002.
- ^ “Intramural coronary delivery of advanced antisense oligonucleotides reduces neointimal formation in the porcine stent restenosis model”. Journal of the American College of Cardiology 39 (10): 1686–91. (May 2002). doi:10.1016/S0735-1097(02)01830-2. PMID 12020498.
- ^ “Vectorization of morpholino oligomers by the (R-Ahx-R)4 peptide allows efficient splicing correction in the absence of endosomolytic agents”. Journal of Controlled Release 116 (3): 304–13. (December 2006). doi:10.1016/j.jconrel.2006.09.011. PMID 17097177.
- ^ “Antiviral effects of antisense morpholino oligomers in murine coronavirus infection models”. Journal of Virology 81 (11): 5637–48. (June 2007). doi:10.1128/JVI.02360-06. PMC 1900280. PMID 17344287.
- ^ “Pharmacokinetics, biodistribution, stability and toxicity of a cell-penetrating peptide-morpholino oligomer conjugate”. Bioconjugate Chemistry 18 (4): 1325–31. (2007). doi:10.1021/bc070060v. PMID 17583927.
- ^ “Design and synthesis of dendritic molecular transporter that achieves efficient in vivo delivery of morpholino antisense oligo”. Bioconjugate Chemistry 19 (7): 1464–70. (July 2008). doi:10.1021/bc8001437. PMID 18564870.
- ^ “Gene knockdowns in adult animals: PPMOs and vivo-morpholinos”. Molecules 14 (3): 1304–23. (March 2009). doi:10.3390/molecules14031304. PMC 6253989. PMID 19325525.
関連文献[編集]
- Wiley-Liss, Inc. Special Issue: Morpholino Gene Knockdowns of genesis Volume 30, Issue 3 Pages 89-200 (July 2001). This is a special issue of Genesis that consists of a series of peer-reviewed short papers using Morpholino knock downs of gene function in various animal and tissue culture systems.
- "Peptide Nucleic Acids, Morpholinos and Related Antisense Biomolecules." eds. Janson & During (Springer, 2007)
- Moulton, Jon (2007). “Using Morpholinos to Control Gene Expression (Unit 4.30)”. In Beaucage, Serge. Current Protocols in Nucleic Acid Chemistry. New Jersey: John Wiley & Sons, Inc.. ISBN 978-0-471-24662-6
