バレレン
| バレレン | |
|---|---|

|

|
Bicyclo[2.2.2]octa-2,5,7-triene | |
| 識別情報 | |
| CAS登録番号 | 500-24-3 |
| PubChem | 136326 |
| ChemSpider | 120100 |
| UNII | 2P5L4Z7K7I |
| |
| |
| 特性 | |
| 化学式 | C8H8 |
| モル質量 | 104.15 g mol−1 |
| 密度 | 1.013 g/mL |
| 沸点 |
153.7 °C, 427 K, 309 °F |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
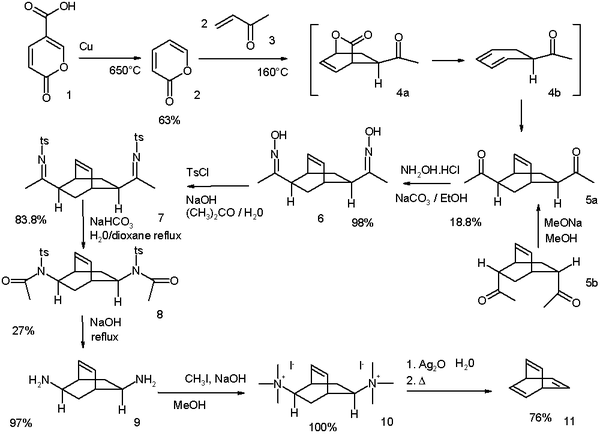
バレレン(Barrelene)は、二環式化合物で、化学式はC8H8である。系統名は、ビシクロ[2.2.2]オクタ-2,5,7-トリエンである。1960年にハワード・ジマーマンにより初めて合成、記述され、樽(Barrel)に似ていることから名付けられた。形式的にはベンゼンとアセチレンのディールス・アルダー反応付加物と考えることができる。異常な分子構造を持つことから、理論化学的な関心を集めている。
関連化合物としてイプチセンが挙げられる。またバレレンは、セミブルバレン等の他の多くの有機化合物の出発物質となる。
1969年に改良された当初のジマーマンの合成法[1]は、クマリン酸を出発物質とする。
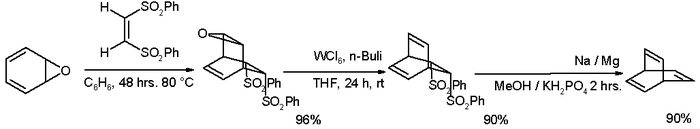
それ以来、多くの代替経路が発見されており、そのうちの1つはオキセピンから出発する[2]。
バレレンと様々な置換バレレン類の合成が可能な方法も提案されている[3]。
反応[編集]
バレレンは、エタノール中アダムス触媒により水素と反応して水素化し、ビシクロ[2.2.2]-オクタンになる。一方、四塩化炭素中で臭素によりカップリング反応が起こり、ジブロモ付加体が生成する。
ペルオキシ一硫酸カリウムによるエポキシド化で、トリオキサトリスホモバレレンを生成する。これは三フッ化ホウ素を作用させるとひずみエネルギーの解放を駆動力として転位し、トリオキサトリスホモキュバンとなる[4]。
この化合物は、反対側の3つの端に3つの酸素原子が挿入されたキュバン、または2つのメチン基が乗った9-クラウン-3と見ることができる。この分子はキラルで、エナンチオマーを分けて単離されている。
特定のバレレンは、開環メタセシス重合のモノマーとして用いられている[5] [6]。
触媒はフィッシャー型カルベン錯体で、溶解のためにモノマーに長いアルキル鎖が付加することが必要である。2,3-ジクロロ-5,6-ジシアノ-p-ベンゾキノンとのポリマーの酸化で、ポリパラフェニレンビニレンのナフタレンペンダントとなる。
バレレンのイソペンタン溶液に光増感剤としてアセトンを加えると、光分解異性化が起こり、セミブルバレンが生じる。長期間の放射によりさらに異性化が進み、シクロオクタテトラエンとなる[7]。

出典[編集]
- ^ Synthesis and physical properties of barrelene, a unique Mobius-like molecule Howard E. Zimmerman, Gary L. Grunewald, Robert M. Paufler, Maynard A. Sherwin J. Am. Chem. Soc.; 1969; 91(9); 2330-2338. doi:10.1021/ja01037a024
- ^ Barrelene, a New Convenient Synthesis Sergio Cossu, Simone Battaggia, and Ottorino De Lucchi J. Org. Chem.; 1997; 62(12) pp 4162-4163; doi:10.1021/jo962267f
- ^ Synthesis of Substituted Bicyclo[2.2.2]octatrienes Michael W. Wagaman, Erika Bellmann, Michele Cucullu, and Robert H. Grubbs J. Org. Chem.; 1997; 62(26) pp 9076-9082; doi:10.1021/jo971039y
- ^ 4,7,11-Triheterotrishomocubanes - Propeller-Shaped Highly Symmetrical Chiral Molecules Derived from Barrelene Sergei I. Kozhushkov et al. European Journal of Organic Chemistry Volume 2006, Issue 11 , Pages 2590 - 2600 Abstract
- ^ Synthesis of Poly(1,4-naphthylenevinylenes): Metathesis Polymerization of Benzobarrelenes Lin Pu, Michael W. Wagaman, and Robert H. Grubbs Macromolecules; 1996; 29(4) pp 1138 - 1143; (Article) doi:10.1021/ma9500143
- ^ Synthesis of Organic and Water Soluble Poly(1,4-phenylenevinylenes) Containing Carboxyl Groups: Living Ring-Opening Metathesis Polymerization (ROMP) of 2,3-Dicarboxybarrelenes Michael W. Wagaman, and Robert H. Grubbs Macromolecules; 1997; 30(14) pp 3978-3985; (Article) doi:10.1021/ma9701595
- ^ Zimmerman, H. E.; Grunewald, G. L. (1966). “The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene”. J. Am. Chem. Soc. 88 (1): 183-184. doi:10.1021/ja00953a045.