テルピリジン
| テルピリジン | |
|---|---|

| |
12,22:26,32-Terpyridine | |
別称 2,6-Bis(2-pyridyl)pyridine, Tripyridyl, 2,2Template:Prime:6Template:Prime,2Template:Pprime-Terpyridine | |
| 識別情報 | |
| CAS登録番号 | 1148-79-4 |
| PubChem | 70848 |
| ChemSpider | 64012 |
| UNII | G5E357ISH5 |
| ChEBI | |
| ChEMBL | CHEMBL89445 |
| |
| |
| 特性 | |
| 化学式 | C15H11N3 |
| モル質量 | 233.27 g mol−1 |
| 外観 | white solid |
| 融点 |
88 °C, 361 K, 190 °F |
| 沸点 |
370 °C, 643 K, 698 °F [1] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
テルピリジン(英: Terpyridine,2,2';6',2"-terpyridine;Terpy,Tpy)は、ピリジンから誘導される複素環式化合物である。
白色の固体で、ほとんどの有機溶媒に可溶である。錯体化学の分野において配位子として使用される。
合成[編集]
テルピリジンは、1932年にピリジンの酸化的カップリング反応によって初めて合成された。この方法は収率が低かったが、その後、主に2-アセチルピリジンから出発する より収率の高い合成法が報告されている[2]。その一つでは、2-アセチルピリジンとN,N-ジメチルホルムアミドジメチルアセタール[注 1]との反応によりエナミノン[注 2]を生成する[3]。2-アセチルピリジンと二硫化炭素を塩基触媒下で反応させヨウ化メチルによりアルキル化することにより、C5H4NCOCH=C(SMe)2が得られる。この分子と2-アセチルピリジンを縮合させると1,5-ジケトンが生成し、酢酸アンモニウムと縮合してテルピリジンが生成する。この誘導体をラネーニッケルで処理すると、チオエーテル基が除去される[4]。
テルピリジンとその誘導体の合成法として、他の方法も開発されている[5]。置換テルピリジンもパラジウム触媒によるクロスカップリング反応から合成される。ビストリアジニルピリジン[注 3]からも調製できる。
物性[編集]
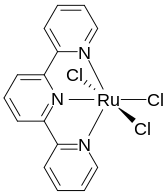
テルピリジンは3座配位子であり、平面上に並ぶ3つの部位で金属と結合し、隣接する2つの5員環(MN2C2[注 4])キレートを形成する[6]。テルピリジンは、2,2'-ビピリジンや1,10-フェナントロリンなどの他のポリピリジン化合物と同様に、ほとんどの遷移金属イオンと錯体を形成する。2つのテルピリジン錯体を含む錯体、すなわち [M(Terpy)2]n+ は一般的である。これらは、関連する [M(Bipy)3]n+ 錯体と構造的に異なり、アキラルである。
テルピリジン錯体は、他のポリピリジン錯体と同様に、可視領域での金属-リガンド電荷移動(metal-ligand charge transfer;MLCT)、可逆的な還元・酸化、非常に強い発光など、特徴的な光学的・電気化学的性質を示す。
テルピリジンとビピリジンはπ電子受容体であるため、酸化状態の低い金属を安定化させる傾向がある。例えばアセトニトリル溶液中では、[M(Terpy)2]+(M = Ni, Co)を生成することが可能である。
関連化合物[編集]
- ビストリアジニルピリジン(BTP)―ピリジンの2,6位に2,k,l-トリアジンを有するBTPは、テルピリジン同様に金属とキレートを形成する。
- クアテルピリジン
関連項目[編集]
脚注[編集]
注釈[編集]
出典[編集]
- ^ Lide, D. R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, Florida: CRC Press, pp. 3–510, ISBN 0-8493-0594-2
- ^ Hofmeier, H.; Schubert, U. S. (2004). “Recent developments in the supramolecular chemistry of terpyridine-metal complexes”. Chem. Soc. Rev. 33 (6): 373–99. doi:10.1039/B400653B. PMID 15280970.
- ^ Jameson, Donald L.; Guise, Lisa E. (1998). “2,2′:6′,2″-Terpyridine”. Inorganic Syntheses. 32. pp. 46–50. doi:10.1002/9780470132630.ch7. ISBN 978-0-471-24921-4
- ^ Potts, K. T.; Ralli, P.; Theodoridis, G.; Winslow, P. (1990). "2,2':6',2' - Terpyridine". Organic Syntheses (英語).; Collective Volume, vol. 7, p. 476
- ^ Kamata, K., Suzuki, A., Nakai, Y., Nakazawa, H., "Catalytic Hydrosilylation of Alkenes by Iron Complexes Containing Terpyridine Derivatives as Ancillary Ligands", Organometallics 2012, 31, 3825. doi:10.1021/om300279t
- ^ Gavrilova, A. L.; Bosnich, B. (2004). “Principles of Mononucleating and Binucleating Ligand Design”. Chemical Reviews 104 (2): 349–383. doi:10.1021/cr020604g. PMID 14871128.



