シアノ酢酸エチル
| シアノ酢酸エチル | |
|---|---|
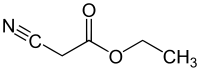
| |
ethyl 2-cyanoacetate | |
| 識別情報 | |
| CAS登録番号 | 105-56-6 |
| PubChem | 7764 |
| |
| 特性 | |
| 化学式 | C5H7NO2 |
| モル質量 | 113.11 g mol−1 |
| 外観 | 無色液体 |
| 危険性 | |
| NFPA 704 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
シアノ酢酸エチルは、カルボン酸エステルとニトリルの構造を持つ有機化合物である。無色の液体 [1]で芳香がある。この化合物は多様な官能基と化学的反応性のために合成の出発物質として有用である。
製造[編集]
シアノ酢酸エチルはいろいろの方法で合成することができる。
- クロロ酢酸とシアン化ナトリウムを使用するコルベ-ニトリル合成法 (Kolbe-nitrile synthesis)[2]。
- 強酸存在下 (例えば濃硫酸) シアノ酢酸とエタノールによるフィッシャーエステル合成反応。シアノ酢酸はコルベ-ニトリル合成法により、クロロ酢酸ナトリウムとシアン化ナトリウムから合成できる。
- 相間移動触媒存在の下、シアノ酢酸ナトリウムとブロモエタンの水-有機溶媒の二相中での反応[3]。
- 触媒として酢酸コバルト(II)四水和物およびラジカル発生剤としての N-ヒドロキシフタルイミドの存在下で 3-エトキシプロピオニトリルの加圧下の酸素による酸化[4]。
性質[編集]
物理的性質[編集]
シアノ酢酸エチルは無色の液体で、大気圧下 209 °Cで沸騰する[5]。蒸気圧は温度範囲 341 - 479 K °でアントワン式 log10(P) = A−(B/(T+C) に従う。(Pの単位は bar、Tは絶対温度 K °, A = 7.46724, B = 3693.663, C = 16.138[6]。固相では 2種類の多形が生ずる[7]。-111 °C 以下では、結晶 II が主であり[7]、それ以上の温度では結晶 I が生じる。その結晶は -22 °Cで融解する[5]。25 °C における熱容量は 220.22 J K−1 mol−1である[5]。
化学的性質[編集]
シアノ酢酸エチルには、3つの異なる反応中心 (ニトリル基、エステル基、酸性メチレン基) があるので、さまざまな機能的および薬理学的に活性な物質のための用途の広い合成用ビルディングブロックである。ニトリル基とカルボニル基にはさまれた酸性のメチレン基を有するため、クネーフェナーゲル縮合やマイケル付加などの縮合反応に使用できる。この反応性はマロン酸エステルと同様である。ニトリルでの反応性の例として、強酸の存在下でシアノ酢酸エチルとエタノールを反応させるとマロン酸ジエチルが生成される[2]。ナトリウムエトキシドの存在下で加熱すると、二量体の3-アミノ-2-シアノ-2-ペンテン二酸ジエチルエステルが生成される[8]。
用途[編集]
その機能性により、シアノ酢酸エチルは次のように反応する。
- さまざまな方法でニトリル基は
- アシル置換の一部としてのエステル基への求核的攻撃:アンモニアとの反応でシアノアセトアミドが生成され、PCl5 または POCl3 による脱水によってマロノニトリルに変換される[10]。
- 求核試薬としての酸性メチレン基を経由して
シアノ酢酸エチルは、例えば医薬品として使用される複素環化合物を合成するためのビルディングブロックである:
- 慢性痛風の治療に使用されるアロプリノールは、オルトギ酸トリエチルとのクネーフェナーゲル縮合から出発して合成することができる。縮合生成物をヒドラジンで環化して置換ピラゾールとし、続いてホルムアルデヒドで置換ピラゾロピリミジンであるアロプリノールを生成する[11]。
- プリン誘導体であるテオフィリン、カフェイン、および尿酸は、シアノ酢酸エチルとN,N'-ジメチル尿素から合成できる[12]。
- プテリジン誘導体の葉酸はビタミB 複合体に割り当てられている:シアノ酢酸エチルとグアニジンは多段階収束的合成の出発物質として使用できる。
- ピロールエトスクシミドはてんかんの治療に用いられ、シアノ酢酸エチルとブタノンから多段階合成で得られる。
- ピリミジン誘導体であるトリメトプリムはスルファメトキサゾールと組み合わせて静菌剤コトリモキサゾールとして使用され、シアノ酢酸エチルと 3,4,5-トリメトキシベンズアルデヒドまたはその塩化ベンジルから合成される。
また、3-置換クマリン誘導体など、他の多くの機能性複素環化合物がシアノ酢酸エチルから高収率で得られる[13]。
この出発物質から得られる非環状化合物は次の通り
シアノ酢酸エチルは、プレニルアミンとドロプレニルアミンの合成に使用される前駆体の 3,3-ジフェニルプロパン-1-アミンの調製にも使用される。
安全性[編集]
LD50 2820mg/kg (ラット、経口投与)[14]
脚注[編集]
- ^ Entry on Cyanessigsäureester. at: Römpp Online. Georg Thieme Verlag, retrieved 2016-06-15
- ^ a b J. K. H. Inglis. "Ethyl Cyanoacetate". Organic Syntheses (英語). doi:10.15227/orgsyn.008.0074。
- ^ EP application 1028105, Hanselmann, Paul & Hildebrand, Stefan, "Process for the preparation of cyanoacetic esters", published 2000-08-16, assigned to Lonza AG
- ^ EP patent 1208081, Hanselmann, Paul & Hildebrand, Stefan, "Method for producing cyanoacetic acid esters", issued 2004-04-14, assigned to Lonza AG
- ^ a b c Record of CAS RN 105-56-6 in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 3. März 2011
- ^ Stull, D.R. (1947). “Vapor Pressure of Pure Substances Organic Compounds”. Ind. Eng. Chem. 39 (4): 517–540. doi:10.1021/ie50448a022.
- ^ a b Khodzhaeva, M.G.; Bugakov, Yu.V.; Ismailov, T.S.: Heat capacity and thermodynamic functions of ethyl cyanoacetate in Khim.-Farm. Zhur. 21 (1987) 760-762, DOI:10.1007/BF00872889.
- ^ Dorokhov, V. A.; Baranin, S. V.; Dib, A.; Bogdanov, V. S. (1992). “'Codimers' of N-(pyrid-2-yl) amides and ethyl cyanoacetate”. Russ. Chem. Bulletin 41 (2): 287–291. doi:10.1007/bf00869516.
- ^ Zheng, Shuyan; Yu, Chunhui; Shen, Zhengwu (2012). “Ethyl Cyanoacetate: A New Cyanating Agent for the Palladium-Catalyzed Cyanation of Aryl Halides”. Org. Lett. 14 (14): 3644–3647. doi:10.1021/ol3014914.
- ^ Mary Eagleson: Concise encyclopedia chemistry, Walter de Gruyter, Berlin - New York 1994, ISBN 3-11-011451-8.
- ^ Axel Kleemann, Jürgen Engel: "Pharmazeutische Wirkstoffe", 2. Aufl., Georg Thieme, Stuttgart - New York 1982, ISBN 3-13-558402-X.
- ^ Beyer-Walter: "Lehrbuch der Organischen Chemie", 24. Aufl., S. Hirzel, Stuttgart - Leipzig 2004.
- ^ Avetisyan, A. A.; Vanyan, É. V.; Dangyan, M. T. (1980). “Synthesis of functionally substituted coumarins”. Chem. Heterocycl. Compounds 15 (9): 959–960. doi:10.1007/BF00473834.
- ^ Harald Strittmatter, Stefan Hildbrand and Peter Pollak "Malonic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a16_063.pub2

