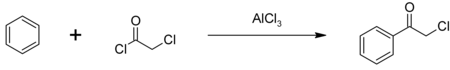クロロアセチルクロリド
| クロロアセチルクロリド | |
|---|---|
| |

| |
chloroacetyl chloride | |
| 識別情報 | |
| CAS登録番号 | 79-04-9 |
| PubChem | 6577 |
| ChemSpider | 13856283 |
| EC番号 | 201-171-6 |
| KEGG | C14859 |
| |
| |
| 特性 | |
| 化学式 | C2H2Cl2O |
| モル質量 | 112.94 g mol−1 |
| 外観 | 無色透明の液体 |
| 匂い | 刺激臭[1] |
| 密度 | 1.42 g/mL |
| 融点 |
-22 °C, 251 K, -8 °F |
| 沸点 |
106 °C, 379 K, 223 °F |
| 水への溶解度 | (水との接触により分解) |
| 有機溶媒への溶解度 | エーテル、ベンゼンに混和。アセトン、トルエン、四塩化炭素に可溶。[1] |
| 蒸気圧 | 19 mmHg (20°C)[2] |
| 危険性 | |
| 安全データシート(外部リンク) | Oxford MSDS |
| EU分類 | |
| 引火点 | 不燃性 ([2]) |
| 許容曝露限界 | none[2] |
| 半数致死量 LD50 | 120mg/kg(ラット、経口)[3] |
| 関連する物質 | |
| 関連物質 | クロロ酢酸、ホスゲン、ビス(クロロメチル)ケトン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
クロロアセチルクロリド(英: Chloroacetyl Chloride)は、クロロ酢酸を塩素化した二官能性化合物で、有機合成化学の中間体として用いられる。
製造[編集]
工業的には塩化メチレンのカルボニル化、1,1-ジクロロエチレンの酸化、またはケテンの塩素化により製造される[4]。クロロ酢酸、塩化チオニル、五塩化リンまたはホスゲンからも生成しうる。
反応[編集]
クロロアセチルクロリドは二官能性化合物であり、容易にエステル[5]やアミドを形成する。分子の一方の端部ともう一方の端部が別の結合を形成することができる。下図はクロロアセチルクロリドを用いたリドカインの合成例である[6] 。
用途[編集]
最も主要な用途は除草剤のアラクロールおよびブタクロールの製造で、年間数億ポンド消費されていると推定される。下図のように塩化アルミニウムを触媒として、フリーデル・クラフツ反応によりベンゼンと結合させることで、催涙剤のクロロアセトフェノンの合成原料ともなる。
安全性[編集]
日本の毒物及び劇物取締法では劇物に区分される。不燃性であるが加熱により分解し、ホスゲンや塩化水素など有害なガスを生じる[7]。眼に対して強い刺激性があり、皮膚の接触、吸入により気道に腐食性がある[3]。
脚注[編集]
- ^ a b クロロアセチルクロリド(東京化成工業)
- ^ a b c NIOSH Pocket Guide to Chemical Hazards 0120
- ^ a b 製品安全データシート(厚生労働省職場のあんぜんサイト)
- ^ Paul R. Worsham (1993). “15. Halogenated Derivatives”. In Zoeller, Joseph R.; Agreda, V. H., eds. (Google Books excerpt). Acetic acid and its derivatives. New York: M. Dekker. pp. 288–298. ISBN 0-8247-8792-7
- ^ Robert H. Baker and Frederick G. Bordwell (1955). "tert-Butyl acetate". Organic Syntheses (英語).; Collective Volume, vol. 3
- ^ T. J. Reilly (1999). “The Preparation of Lidocaine”. J. Chem. Ed. 76 (11): 1557. doi:10.1021/ed076p1557.
- ^ 国際化学物質安全性カード