精子形成
精子発生 (せいしはっせい、英: spermatogenesis)は、オスの始原生殖細胞から有糸分裂および減数分裂を通じて精子が形成される過程である。この経路における初期の細胞は精原細胞であり、精原細胞の有糸分裂によって一次精母細胞が形成される。一次精母細胞は2つの二次精母細胞に減数分裂(減数分裂第一分裂)する。それぞれの二次精母細胞が減数分裂第二分裂をし、2つの精細胞に分かれる。精細胞は成熟し、精子に分化する。このように、一次精母細胞から2つの二次精母細胞が生じ、それらがさらに分裂して4つの二次精母細胞になり、それぞれが4つの精子となる[1]。
精子は、多くの有性生殖生物においてオスの成熟した配偶子である。男性における精子形成は女性における卵形成に相当し、どちらの過程も配偶子形成と呼ばれる。哺乳類では、男性の精巣の精細管で段階的な分化が行われる。精子形成が正常に行われるためには最適な環境であることが非常に重要であり、有性生殖に必須である。DNAのメチル化およびヒストン修飾は、この過程の調節に関与している[2]。精子形成は思春期から始まり、加齢とともに形成される精子の量はわずかに減少するが、個体が死ぬまで中断することなく継続される。男性不妊の項目も参照。
目的[編集]
精子形成は、オスの成熟した配偶子である精子を形成する過程である。精子はメスの配偶子である卵と受精し、接合体である受精卵が形成される。これが有性生殖の基礎である。2つの配偶子は両方とも半数体であり、通常の半分のセットの染色体を持っている。受精によって、正常な染色体数の(二倍体の)受精卵となる。正常な染色体数は種によって異なる。子孫の染色体の数を正常に維持するには、各配偶子は他の体細胞の半分の数の染色体を持っている必要がある。配偶子が体細胞と同じ染色体数である場合、子孫の染色体数は通常の2倍になり、深刻な異常が生じる可能性がある。ヒトでは、染色体数の異常は先天性の遺伝子疾患(ダウン症候群、クラインフェルター症候群)を引き起こし、胎児の自然流産につながることも多い。精子形成の段階で染色体数に異常があればこういった疾患につながる。
所在[編集]
精子形成は、男性生殖器系のいくつかの構造内で行われる。初期段階は精巣内で起こり、その後に精巣上体へ移る。精巣上体では配偶子が成熟し、射精まで保存される。この過程は精巣の精細管から開始される。精細管の基底側には幹細胞があり、そこから分裂が始まり、管の最も内側の内腔へ進むに従って発生が進む。成熟は精巣上体で起こる。成熟した精子を形成するために、精子形成の過程は37°C(通常の体温)より1–8℃低い温度を必要とする。そのため、精巣や陰嚢の温度は特に重要である[3]。精巣や陰嚢が身体からぶらさがっているような構造をしていることは、温度をコントロールするうえで重要である。臨床的には、小さな温度の変動は、精子の生存率や数の減損にはつながらない[4]。
期間[編集]
ヒトの場合は、精子形成の過程全体は74日[5][6] (トリチウム標識生検による)から、約120日[7] (DNAクロック測定による)かかると推定されている。管などを通過する時間も含めると、3か月を要する。精子は毎日2億個から3億個は形成されている[8]が、成熟した精子になるのは約半分または1億個程度である[9]。
ステージ[編集]
精子形成の過程の各々の段階は、細胞の種類で分けることができる。次の表のように、倍数性、コピー数および染色体数、細胞にふくまれるDNA量、細胞分裂の種類などで区分できる。一次精母細胞は、DNA合成の後に細胞分裂を行う。
| セルタイプ | 倍数性/ヒトでの染色体数 | DNAコピー数/ヒトでの染色体数 | 後におこなう過程 |
| 精原細胞 spermatogonium | 二倍体(2N)/46 | 2C/46 | spermatocytogenesis (細胞分裂) |
| 一次精母細胞 primary spermatocyte | 二倍体(2N)/46 | 4C/2x46 | spermatidogenesis (一次減数分裂) |
| 二次精母細胞 two secondary spermatocytes | 一倍体(N)/23 | 2C/2x23 | spermatidogenesis(二次減数分裂) |
| 精細胞 four spermatids | 一倍体(N)/23 | C/23 | spermiogenesis 精子形成 |
| 精子 spermatozoids | 一倍体i(N)/23 | C/23 | spermiation 排精 |
精母細胞形成 Spermatocytogenesis[編集]

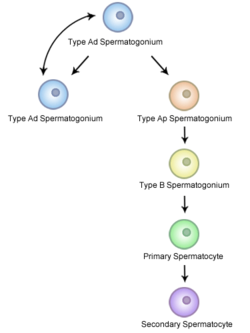
精母細胞形成はオスの生殖母細胞の形成過程であり、通常の半分の遺伝物質を持つ、すなわち半数体の精細胞の形成をもたらす。精母細胞形成では、精細管の基底部分に存在する二倍体の精原細胞は体細胞分裂を行い、一次精母細胞と呼ばれる2つの二倍体の細胞を産生する。一次精母細胞は精細管の管の内側に移動してDNAを複製した後に減数分裂を行い、半数体の二次精母細胞となる。減数分裂では配偶子の遺伝的多様性を高めるため、両親から受け継いだ染色体をランダムに分配するほか、相同染色体どうしを交差させるなどの遺伝的変異がおこる。
精原細胞から精細胞への分裂では、各細胞は完全には分離しない。細胞が同期して分化できるように細胞質は橋渡しされ、相互に接続されたままになっている。また、精原細胞の分裂によって生じるすべての細胞が精母細胞となるわけではない。精原細胞がなくなってしまうことがないように、精原細胞は体細胞分裂を行って確実に自分自身のコピーを形成する[10]。
減数分裂第二分裂 Spermiogenesis[編集]
二次精母細胞の減数分裂第二分裂によって、半数体の精細胞と形成される。この段階はすばやく進むため、二次精母細胞はほとんどの組織学的観察では観察されない。
精子形成 Spermiogenesis[編集]
精子形成の間に、精細胞では中心小体を基礎として微小管が細長く成長し、精子の尾部を形成し始める。これらの微小管は、鞭毛を形成する。エネルギー供給を確保するためにミトコンドリアが鞭毛の周囲に配置されるため尾部の前部は厚くなり、この部分は中片と呼ばれる。精細胞DNAは高度に凝縮され、パッケージングされる。DNAは特定の核塩基性タンパク質によってパッケージングされた後、そのタンパク質は精細胞の伸長時にプロタミンと呼ばれるタンパク質で置換される。その結果形成された凝縮クロマチンは転写されることはない。ゴルジ装置は先体となり、凝縮核を取り囲む。
その後、テストステロンの影響下で成熟が起こり、残りの不要な細胞質と細胞小器官が除去される。残留体と呼ばれる余剰の細胞質は、精巣中で周囲を取り囲んでいるセルトリ細胞により貪食される。形成された精子は成熟しているが、運動性はない。排精と呼ばれる過程で、精細管の内腔の保護セルトリ細胞から放出される。
非運動性の精子が蠕動収縮の助けを借りてセルトリ細胞によって分泌され、精巣液中の精巣上体に輸送される。精巣上体で精子は運動性を獲得し、受精できるようになる。しかし、成熟した精子の生殖器系の残りの部分の移動は、精子がここで獲得した運動性ではなく、筋肉の収縮によって行われる。
セルトリ細胞の役割[編集]
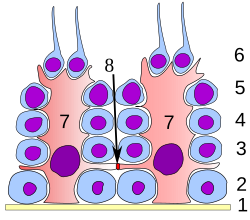
分化のすべての段階で、精子になる細胞はセルトリ細胞と密接に接触している。セルトリ細胞は分化途上の精細胞を構造的および代謝的にサポートすると考えられている。精細管の基底膜から内腔へ、単一のセルトリ細胞が延びている。セルトリ細胞は、次の方法で分化途上の配偶子をサポートし、精子形成に多くの機能を果たす。
- 血液精巣関門を構築することで、分化および成熟のために必要な環境を維持する。
- 減数分裂を開始する物質を分泌する。
- 精巣周辺の体液を分泌する。
- アンドロゲン結合タンパク質(ABP)を分泌する。ABPは、分化途上の配偶子の近傍でテストステロンを濃縮する。テストステロンは、生殖器官の維持のために高濃度で必要とされる。ABPによる高い濃縮がなければ不妊になる。
- 下垂体による精子形成制御に影響を与えるホルモン、特にポリペプチドホルモンであるインヒビンを分泌する。
- 精子形成の際に残留する細胞質を貪食する。
- 抗ミュラー管ホルモンを分泌し、ミュラー管の形成を防ぐ[11]。
- 血液精巣関門を形成することで、免疫系から精細胞を保護する。
- 細胞間接着分子であるICAM-1、および可溶性ICAM-1は、血液精巣関門を形成する密着結合に対して拮抗的作用を有する分子である[12]。ICAM-2分子は関門の頂端側と精細胞との接着を調節する[12]。
要因影響[編集]
精子形成過程は、環境の変動、特にホルモンや温度に非常に敏感である。テストステロンは精細管に存在するアンドロゲン結合タンパク質による結合によって局所的に高濃度となり、この濃縮は精子形成の過程に必要である。テストステロンは、精細管に隣接しているライディッヒ細胞と呼ばれる間質細胞によって産生される。ヒトや他の動物では精上皮は高温に弱く、正常体温より高温では悪影響を受ける。そのため、精巣は陰嚢と呼ばれる皮膚の袋に包まれ、身体の外側にぶらさがっている。最適温度は、体温より2°C(ヒト、マウスでは8°C)低い温度に維持される。温度は、精巣挙筋と肉様膜陰嚢の平滑筋によって身体から離されたり近づいたりすることや、血流[13] によって調整される。アナボリックステロイド、金属(カドミウム、鉛)、栄養欠乏(ビタミンB、E、Aなど)、X線への曝露、ダイオキシン、アルコール、および感染症も精子形成の速度に悪影響を与える。[要出典] また雄性生殖細胞系列は、酸化ストレスによって引き起こされるDNA損傷に大して感受性であり、この損傷はおそらく受精および妊娠に大きな影響を与える[14]。殺虫剤への曝露も、精子形成に影響を与える[15]。
ホルモン制御[編集]
精子形成のホルモン制御は、種によって異なる。ヒトでのメカニズムは完全には理解されていない。しかし精子形成の開始が、視床下部、下垂体とライディッヒ細胞との相互作用で思春期に起こることが知られている。下垂体が除去されている場合、卵胞刺激ホルモン(FSH)およびテストステロンによって精子形成を開始させることができる[16]。FSHとは対照的に、黄体形成ホルモン(LH)は生殖腺のテストステロン産生を誘導する以外には精子形成に役割を果たさない[16][17]。
FSHはセルトリ細胞によるアンドロゲン結合タンパク質(ABP)の産生、および血液精巣関門の形成の両方を刺激する。ABPは、テストステロンを精子形成の維持に十分な高いレベルに濃縮するために不可欠である。精巣内のテストステロン濃度は、健康な男性の間で5–10倍の幅があるものの、血液中に見られる濃度よりも20–100または50–200倍高い[18][19]。FSHは精巣内にテストステロンをとらえて濃縮させることができるが、いったん発生が開始されると精子形成の維持にはテストステロンのみが必要となる[16]。しかし、FSHが増加するとタイプA精原細胞のアポトーシスを防止することにより、精子の産生を増加させる。インヒビンはFSHのレベルを減少させるように作用する。げっ歯類のモデル生物からの研究により、性腺刺激ホルモン(LHおよびFSHの両方)は、アポトーシスを促進するシグナルを抑制することにより、精子形成過程をサポートし、精子形成細胞の生存を促進することが示唆されている[20]。
セルトリ細胞自体はホルモン産生を介して精子形成の一部を媒介する。セルトリ細胞は、エストラジオールおよびインヒビンを産生することができる。ライディッヒ細胞は主にテストステロンを産生し、エストラジオールも産生することができる。エストロゲンは、動物における精子形成に必須であることが判明している[21][22]。エストロゲン非感受性症候群(ERαが欠損)の男性は、精子数は正常であるが精子の生存能力は異常に低いことが報告されている(不妊かどうかは不明)[23]。エストロゲンの異常な高値は、性腺刺激ホルモン分泌の抑制および精巣内のテストステロン産生過剰の原因になり、精子形成に有害である可能性がある[24]。また、プロラクチンは精子形成に重要なようである[17]。
出典[編集]
- ^ “The Spermatozoön, in Gray's Anatomy”. 2010年10月7日閲覧。
- ^ Song, Ning (2011). “Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis”. Acta Histochemica et Cytochemica 44 (4): 183–90. doi:10.1267/ahc.11027. PMC 3168764. PMID 21927517.
- ^ "scrotum".
- ^ “Effect of increased scrotal temperature on sperm production in normal men”. Fertil. Steril. 68 (2): 334–9. (1997). doi:10.1016/s0015-0282(97)81525-7. PMID 9240266.
- ^ “Kinetics of the germinal epithelium in man”. Recent Prog Horm Res 20: 545–571. (1964).
- ^ “The cycle of the seminiferous epithelium in humans: a need to revisit?”. J Androl 29 (5): 469–487. (2008). doi:10.2164/jandrol.107.004655. PMID 18497337.
- ^ “Elevated germline mutation rate in teenage fathers”. Proc R Soc B 282: 20142898. (2015). doi:10.1098/rspb.2014.2898. PMC 4345458. PMID 25694621.
- ^ Padubidri, VG; Daftary, SN, eds (2011). Shaw's Textbook of Gynaecology (15th ed.). p. 201. ISBN 978-81-312-2548-6
- ^ “Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production”. Biol. Reprod. 29 (1): 207–15. (1983). doi:10.1095/biolreprod29.1.207. PMID 6615966.
- ^ Fishelson, Lev (2007). “Comparative spermatogenesis, spermatocytogenesis, and spermato-zeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei)”. The Anatomical Record 290 (3): 311–23. doi:10.1002/ar.20412. PMID 17525946.
- ^ Hadley, Mac E.; Levine, Jon E. (2007). Endocrinology (6th ed.). Upper Saddle River, NJ: Prentice Hall. p. 369. ISBN 0-13-187606-6
- ^ a b Xiao, X. (2013). “Intercellular adhesion molecules (ICAMs) and spermatogenesis”. Human Reproduction Update 19 (2): 167–86. doi:10.1093/humupd/dms049. PMC 3576004. PMID 23287428.
- ^ Harrison, RG (1949). “Vascular patterns of the mammalian testis and their functional significance”. The Journal of Experimental Biology 26 (3): 304–16, 2 pl. PMID 15407652.
- ^ Lewis, SE (2005). “DNA damage to spermatozoa has impacts on fertilization and pregnancy”. Cell and tissue research 322 (1): 33–41. doi:10.1007/s00441-005-1097-5. PMID 15912407.
- ^ Mehrpour, O (2014). “Occupational exposure to pesticides and consequences on male semen and fertility: A review.”. Toxicol Lett 230: 146–156. doi:10.1016/j.toxlet.2014.01.029. PMID 24487096.
- ^ a b c William J. Kraemer; A. D. Rogol (15 April 2008). The Encyclopaedia of Sports Medicine: An IOC Medical Commission Publication, The Endocrine System in Sports and Exercise. John Wiley & Sons. pp. 286–. ISBN 978-0-470-75780-2
- ^ a b “Effects of drugs on the male and female reproductive systems”. Ann. Clin. Lab. Sci. 15 (6): 451–8. (1985). PMID 4062226.
- ^ Wolf-Bernhard Schill; Frank H. Comhaire; Timothy B. Hargreave (26 August 2006). Andrology for the Clinician. Springer Science & Business Media. pp. 76–. ISBN 978-3-540-33713-3
- ^ Eberhard Nieschlag; Hermann M. Behre; Susan Nieschlag (26 July 2012). Testosterone: Action, Deficiency, Substitution. Cambridge University Press. pp. 130–. ISBN 978-1-107-01290-5
- ^ Pareek, Tej K. (2007). “Insights into male germ cell apoptosis due to depletion of gonadotropins caused by GnRH antagonists”. Apoptosis 12 (6): 1085–100. doi:10.1007/s10495-006-0039-3. PMID 17268770.
- ^ “Estrogen and spermatogenesis”. Endocr. Rev. 22 (3): 289–318. (2001). doi:10.1210/edrv.22.3.0431. PMID 11399746.
- ^ “Role of estrogens in spermatogenesis”. Front Biosci (Elite Ed) 4: 1–11. (2012). PMID 22201851.
- ^ Smith, Eric P. (1994). “Estrogen Resistance Caused by a Mutation in the Estrogen-Receptor Gene in a Man”. New England Journal of Medicine 331 (16): 1056–1061. doi:10.1056/NEJM199410203311604. ISSN 0028-4793. PMID 8090165.
- ^ Edmund S. Sabanegh, Jr. (20 October 2010). Male Infertility: Problems and Solutions. Springer Science & Business Media. pp. 83–. ISBN 978-1-60761-193-6
参考文献[編集]
- “The testes and spermatogenesis”. University of Wisconsin (1998年). 2006年11月27日閲覧。
- Johnson, L. (1997). “Factors affecting spermatogenesis in the stallion”. Theriogenology 48 (7): 1199–216. doi:10.1016/S0093-691X(97)00353-1. PMID 16728209.
- Bardin, C.W. (1991). “Pituitary-testicular axis”. Reproductive Endocrinology (3rd ed.). Philadelphia: WB Saunders. ISBN 0721632068
- Chambers, CV (1987). “Microflora of the urethra in adolescent boys: Relationships to sexual activity and nongonococcal urethritis”. The Journal of Pediatrics 110 (2): 314–21. doi:10.1016/S0022-3476(87)80180-4. PMID 3100755.
- Czyba, J.C.; Girod, C. (1980). “Development of normal testis”. In Hafez, E.S.E.. Descended and Cryptorchid Testis. The Hague: Martinus Nijhoff. ISBN 9024723337
- Whitmore Wf, 3rd (1985). “The role of germinal epithelium and spermatogenesis in the privileged survival of intratesticular grafts”. The Journal of Urology 134 (4): 782–6. PMID 2863395.
関連項目[編集]
- Anisogamy
- Evolution of sexual reproduction
- 卵胞形成
- 生殖細胞
- 精子
- 男性不妊症
- 減数分裂
- Oncofertility
- Oogenesis
- Origin and function of meiosis
- セルトリ細胞
- 有性生殖
- Semen analysis
