「三酸化硫黄」の版間の差分
AlleborgoBot (会話 | 投稿記録) m ロボットによる 追加: fi:Rikkitrioksidi |
Chembox new |
||
| 1行目: | 1行目: | ||
{{Chembox new |
|||
{{ Infobox 化合物 |
|||
| |
| Name = 三酸化硫黄 |
||
| |
| ImageFileL1 = Sulfur-trioxide-2D-dimensions.png |
||
| ImageSizeL1 = 120px |
|||
| IUPAC名=三酸化硫黄 | 別名=無水硫酸 |
|||
| ImageNameL1 = 三酸化硫黄の構造 |
|||
| 分子式=SO<sub>3</sub> | 分子量=80.06 |
|||
| ImageFileR1 = Sulfur-trioxide-3D-vdW.png |
|||
| 組成式= | 式量= |
|||
| ImageSizeR1 = 120px |
|||
| 形状=液体(常温常圧下) | CAS登録番号=7446-11-9 | SMILES= |
|||
| ImageNameR1 = 三酸化硫黄の空間充填モデル |
|||
| 密度=1.92 | 相= |
|||
| IUPACName = 三酸化硫黄 |
|||
| 相対蒸気密度= |
|||
| OtherNames = 無水硫酸 |
|||
| 水への溶解度= |
|||
| Section1 = {{Chembox Identifiers |
|||
| 溶媒2= | 溶解度2= g/100 mL ( ℃) |
|||
| CASNo = [7446-11-9] |
|||
| 溶媒3= | 溶解度3= g/100 mL ( ℃) |
|||
}} |
|||
| 融点=32.5~62.3 | 融点注= |
|||
| Section2 = {{Chembox Properties |
|||
| 沸点=45 | 沸点注= |
|||
| Formula = SO<sub>3</sub> |
|||
| 昇華点= | 昇華点注= |
|||
| MolarMass = 80.06 g mol<sup>−1</sup> |
|||
| pKa= | pKb= |
|||
| Density = 1.92 g cm<sup>−3</sup> |
|||
| 比旋光度= | 粘度= | 屈折率= |
|||
| MeltingPt = 16.9 ℃ |
|||
| 出典=[http://www.k-erc.pref.kanagawa.jp/kisnet/ Kis-Net] |
|||
| BoilingPt = 45 ℃ |
|||
| Solubility = 水と反応 |
|||
}} |
|||
| Section4 = {{Chembox Thermochemistry |
|||
| DeltaHf = −397.77 kJ mol<sup>-1</sup> |
|||
| Entropy = 256.77 JK<sup>−1</sup> mol<sup>−1</sup> |
|||
}} |
|||
| Section7 = {{Chembox Hazards |
|||
| EUClass = 腐食性 ('''C''') |
|||
| RPhrases = {{R14}}, {{R35}}, {{R37}} |
|||
| SPhrases = {{S1}}, {{S2}}, {{S26}}, {{S30}}, {{S45}} |
|||
}} |
|||
| Section8 = {{Chembox Related |
|||
| OtherCpds = [[二酸化硫黄]]<br />[[硫酸]]<br />[[塩化スルフリル]] |
|||
}} |
|||
}} |
}} |
||
2009年2月1日 (日) 01:08時点における版
| 三酸化硫黄 | |
|---|---|
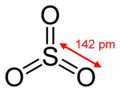
|

|
三酸化硫黄 | |
別称 無水硫酸 | |
| 識別情報 | |
| CAS登録番号 | [7446-11-9 [7446-11-9]] |
| 特性 | |
| 化学式 | SO3 |
| モル質量 | 80.06 g mol−1 |
| 密度 | 1.92 g cm−3 |
| 融点 |
16.9 ℃ |
| 沸点 |
45 ℃ |
| 水への溶解度 | 水と反応 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−397.77 kJ mol-1 |
| 標準モルエントロピー S |
256.77 JK−1 mol−1 |
| 危険性 | |
| EU分類 | 腐食性 (C) |
| Rフレーズ | R14, R35, R37 |
| Sフレーズ | (S1), (S2), S26, S30, S45 |
| 関連する物質 | |
| 関連物質 | 二酸化硫黄 硫酸 塩化スルフリル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
三酸化硫黄(さんさんかいおう、英:Sulfur trioxide)は、硫黄の酸化物で、化学式 SO3 で表される。無水硫酸とも呼ばれ、水に溶かすと硫酸となるため大量に工業生産されている。酸性雨の原因物質の1つであり、日本では大気汚染防止法により特定物質に指定されている。
構造と結合
原子価殻電子対反発則から、気体のSO3は硫黄原子を中心とした平面正三角形構造(D3h対称)を取ると予測されている。
電子状態に着目すると硫黄原子の酸化数は+6、電荷は0であり、6つの電子対を保持している。分子軌道法の点から見ると、これらの電子対のほとんどは非結合的な性質を持っており、典型的な超原子価分子となっている。
化学的性質
三酸化硫黄は硫酸の無水物であり、水と以下のような反応が起こる。
- SO3(l) + H2O(l) → H2SO4(l) (+88 kJ mol−1)
この反応は急速な発熱反応である。340℃以上では、硫酸、三酸化硫黄、水の間で平衡が成立する。
- SO3 + SCl2 → SOCl2 + SO2
なお三酸化硫黄を濃硫酸に溶かしたものは発煙硫酸と呼ばれている。
生成
三酸化硫黄は研究室では硫酸水素ナトリウムの熱分解により2段階で合成できる。
- 1) 脱水
- 2NaHSO4 → Na2S2O7 + H2O @ 315°C
- 2) 熱分解
- Na2S2O7 → Na2SO4 + SO3 @ 460°C
他の金属の硫酸水素塩を用いても反応は進行する。この場合、反応条件は中間体の安定性に依存する。
工業的には三酸化硫黄は接触法により製造されている。まず硫黄もしくは黄鉄鉱の燃焼により二酸化硫黄(亜硫酸ガス)を合成し、電気集塵により精製する。その後二酸化硫黄を酸素及び五酸化バナジウムの存在下で400~600℃に加熱し酸化すると得られる。
- S + O2 → SO2
- 2SO2 + O2 → 2SO3
接触法については記事硫酸#工業的製法に詳しいので、そちらも参照のこと。
また、二酸化硫黄が二酸化窒素と反応してもできる。
- SO2 + NO2 → SO3 + NO
固体の構造

固体のSO3は微量の水に依存した複雑な挙動を示す[1]。気体が凝集すると、純粋な三酸化硫黄がγ-SO3と呼ばれる三量体を形成する。この固体は無色で融点は16.8℃である。この環状構造は[S(=O)2(μ-O)]3と表記されている[2]。
SO3が27℃以上で凝集してできる相は融点が62.3℃であり、α-"SO3と呼ばれている。α-"SO3の見た目はアスベストのような繊維状である。[S(=O)2(μ-O)]n型の高分子であり、末端はヒドロキシル基になっている。β-SO3と呼ばれる相もα型と同じく針状であるが分子量と融点が異なり、融点は32.5℃である。γ相とβ相は準安定相であり、時間の経過に伴い安定なα相へと徐々に相転移する。この相転移には微量の水が関わっている[3]。
固体の蒸気圧は同一温度ではα < β < γの順に大きくなる。また液体の蒸気圧はγ相の値とほぼ同じである。このためα-SO3の結晶を加熱すると、ガラス容器を粉砕するに十分な程の蒸気圧の急増が見られる。この現象はα爆発と呼ばれている[3]。
SO3は高い吸湿性を持つ。熱濃硫酸を木や綿に浸すと発火するが、これは SO3が木や綿の炭化水素に含まれている水分を脱水してしまい、炭化水素が燃えやすくなるためである[3]。
