フィブロネクチンIII型ドメイン
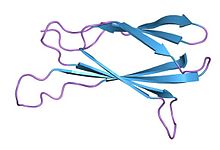
フィブロネクチンIII型ドメイン(フィブロネクチン さんがた ドメイン 英: Fibronectin type III domain、Fibronectin type III module、Fibronectin type III repeat、FNIII、FN3)は、最初、フィブロネクチン(タンパク質)内部のポリペプチドの繰返し構造として発見された。その後、他の細胞外マトリックスタンパク質に類似ドメインがあること、たくさんの動物タンパク質に類似ドメインがあること、生物種を越えた酵母、植物、細菌に類似ドメインがあることから、進化の過程で保存されたタンパク質ドメインの1つだと考えられている。
1つのフィブロネクチンIII型ドメインは、アミノ酸約100個からなる安定した構造である。βサンドイッチ(β-sandwich)構造を持ち、免疫グロブリンドメインと似ている[1]。
用語[編集]
ドメイン(domain)という用語は、もう少し大きいかたまりに対して用いることが多い(例:ヘパリン結合ドメイン)。この場合、本項目に該当する用語は、「モジュール(module)」[2]、あるいは「繰返し(repeat)」の方が妥当である[3]。その場合、1つのドメイン(domain)は数個の「モジュール(module)」(あるいは「繰返し(repeat)」)で構成されることになる。
発見[編集]
1983年、デンマーク・オーフス大学のトーベン・ピーターセン(Torben E. Petersen)らは、タンパク質化学の手法でフィブロネクチンの一次構造の解析をし、まだ半分(推定1,880個の内、911個)しか解析が終わっていなかったが、論文として発表した。半分の解析ではあったが、フィブロネクチンの一次構造に3種類の内部ホモロジーが存在することを発見した。フィブロネクチンI型ドメイン、フィブロネクチンII型ドメイン、フィブロネクチンIII型ドメインと命名し、それぞれ、9個、2個、4個確認した[4]。
解析が半分しか終わっていないのに論文を発表したのは、この頃、簡便・迅速なDNAシークエンシングから一次構造を決定す手法が世界の研究室に導入され始めていたためである。タンパク質化学の手法で全一次構造の決定をするには、さらに3年の年月が必要だった。
1986年、デンマーク・オーフス大学のグループは、タンパク質化学の手法でフィブロネクチンの全一次構造を決定した。その時、フィブロネクチンIII型ドメインを15個と発表した[5]。
一方、タンパク質化学での発表の翌年の1984年、やはりというべきか、米国・マサチューセッツ工科大学のリチャード・ハインズの研究室が、DNAシークエンシングから、フィブロネクチンの全一次構造を決定した。フィブロネクチンI型ドメイン、フィブロネクチンII型ドメイン、フィブロネクチンIII型ドメインを確認した[6]。
このドメインを持つヒト・タンパク質[編集]
フィブロネクチン; ABI3BP; ANKFN1; ASTN2; AXL; BOC; BZRAP1; C20orf75; CDON; CHL1; CMYA5; CNTFR; CNTN1; CNTN2; CNTN3; CNTN4; CNTN5; CNTN6; コラーゲン(COL12A1); コラーゲン(COL14A1); コラーゲン(COL20A1); コラーゲン(COL7A1); CRLF1; CRLF3; CSF2RB; CSF3R; DCC; DSCAM; DSCAML1; EBI3; EGFLAM; EPHA1; EPHA10; EPHA2; EPHA3; EPHA4; EPHA5; EPHA6; EPHA7; EPHA8; EPHB1; EPHB2; EPHB3; EPHB4; EPHB6; EPOR; FANK1; FLRT1; FLRT2; FLRT3; FNDC1; FNDC3A; FNDC3B; FNDC4; FNDC5; FNDC7; FNDC8; FSD1; FSD1L; FSD2; GHR; HCFC1; HCFC2; HUGO; IFNGR2; IGF1R; IGSF22; IGSF9; IGSF9B; IL11RA; IL12B; IL12RB1; IL12RB2; IL20RB; IL23R; IL27RA; IL31RA; IL6R; IL6ST; IL7R; INSR; INSRR; ITGB4; Il6ST; KAL1; KALRN; L1CAM; LEPR; LIFR; LRFN2; LRFN3; LRFN4; LRFN5; LRIT1; LRRN1; LRRN3; MERTK; MID1; MID2; MPL; MYBPC1; MYBPC2; MYBPC3; MYBPH; MYBPHL; MYLK; MYOM1; MYOM2; MYOM3; NCAM1; NCAM2; NEO1; NFASC; NOPE; NPHS1; NRCAM; OBSCN; OBSL1; OSMR; PHYHIP; PHYHIPL; PRLR; PRODH2; PTPRB; PTPRC; PTPRD; PTPRF; PTPRG; PTPRH; PTPRJ; PTPRK; PTPRM; PTPRO; PTPRS; PTPRT; PTPRU; PTPRZ1; PTPsigma; PUNC; RIMBP2; ROBO1; ROBO2; ROBO3; ROBO4; ROS1; SDK1; SDK2; SNED1; SORL1; SPEG; TEK; TIE1; テネイシン(TNC); テネイシン(TNN); テネイシン(TNR); テネイシン(TNXB); TRIM36; TRIM42; TRIM46; TRIM67; TRIM9; チチン(TTN); TYRO3; UMODL1; USH2A; VASN; VWA1; dJ34F7.1; fmi;
応用[編集]
フィブロネクチンIII型ドメインを利用し、特定の標的に結合する抗体医薬品(モノボディ、アドネクチン Adnectin)が開発されている。
脚注・文献[編集]
- ^ Explanation of all-beta topologies: 1996 Birkbeck College (University of London) Advanced Certificate in The Principles of Protein Structure Using the Internetn SCOP classification.(英語)2014年3月20日閲覧
- ^ PLitvinovich SV1, Strickland DK, Medved LV, Ingham KC. (1991). “Domain structure and interactions of the type I and type II modules in the gelatin-binding region of fibronectin. All six modules are independently folded.”. J Mol Biol. 217: 563-575. PMID 1994038.
- ^ Pankov R, Yamada KM. (2002). “Fibronectin at a glance.”. J Cell Sci. 115: 3861?3863. doi:10.1242/jcs.00059. PMID 12244123.
- ^ Petersen TE, Thogersen HC, Skorstengaard K, Vibe-Pedersen K, Sahl P, Sottrup-Jensen L, Magnusson S. (Jan 1983). “Partial primary structure of bovine plasma fibronectin: three types of internal homology.”. Proc Natl Acad Sci U S A 80: 137-141. PMC 393325. PMID 6218503.
- ^ Skorstengaard K, Jensen MS, Sahl P, Petersen TE, Magnusson S. (Dec 1986). “Complete primary structure of bovine plasma fibronectin.”. Eur J Biochem. 161 (2): 441-453. PMID 3780752.
- ^ Hynes RO, Schwarzbauer JE, Tamkun JW. (1984). “Fibronectin: a versatile gene for a versatile protein.”. Ciba Found Symp. 108: 75-92. PMID 6569832.
