FOXO1
FOXO1(forkhead box protein O1)またはFKHR(forkhead in rhabdomyosarcoma)は、ヒトではFOXO1遺伝子にコードされるタンパク質である[5]。FOXO1はインスリンシグナルによる糖新生と解糖系の調節に重要な役割を果たす転写因子であり、また脂肪前駆細胞から脂肪細胞への分化(アディポジェネシス)の決定に中心的な役割を果たす[6]。主に複数の残基へのリン酸化によって調節されており、その転写活性はリン酸化状態に依存している[7][8]。
機能[編集]
アディポジェネシス[編集]

FOXO1はアディポジェネシスを負に調節する[9]。現在のところ、その正確な機構は完全には理解されていない。現在受け入れられているモデルでは、FOXO1はPPARG遺伝子のプロモーター部位に結合して転写を阻害することでアディポジェネシスを負に調節する。PPARGレベルの上昇はアディポジェネシスの開始に必要であるため、FOXO1が転写を阻害することでアディポジェネシスの開始が阻害される。インスリン刺激時にはFOXO1は核から除去され、PPARGの転写を防いでアディポジェネシスを阻害することができなくなる[10]。一方で、FOXO1とPPARGプロモーターの間の相互作用を媒介する他の因子が存在すること、またアディポジェネシスの阻害は完全にFOXO1によるPPARG転写阻害に依存しているわけではないこと示唆する証拠も得られている[11]。アディポジェネシスの阻害は、主に活性化したFOXO1が下流の未知の標的の活性化を介して細胞をG0/G1期で停止させるためであり、その下流標的の候補としてはSOD2が考えられている[12]。
FOXO1は転写因子のフォークヘッドファミリーに属し、このファミリーのタンパク質はフォークヘッドドメインの存在によって特徴づけられる。このタンパク質は筋原性細胞の成長と分化にも関与している可能性がある[13]。FOXO1はヒトの胚性幹細胞の多能性の維持にも必要不可欠である。この機能はFOXO1によるOCT4、SOX2遺伝子の直接的な制御によるものであり、FOXO1はそれぞれのプロモーターに結合して活性化を行う[14]。肝細胞では、FOXO1はホスホエノールピルビン酸カルボキシキナーゼやグルコース-6-ホスファターゼ(メトホルミン/AMPK/SHP経路を介して遮断される酵素)の発現を増加させるようである。この転写因子の遮断は糖尿病の新たな治療法となる可能性がある[15]。膵臓α細胞では、FOXO1はプレプログルカゴンの発現調節に重要である[16]。膵臓β細胞では、FOXO1はβ細胞量に対するGLP-1の作用を媒介する[17]。
糖新生と解糖系[編集]
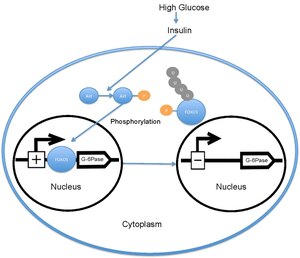
血糖値が高い場合、膵臓はインスリンを血中へ放出する。インスリンはPI3Kの活性化を引き起こし、PI3KはAktをリン酸化する。AktはFOXO1をリン酸化し、核からの除去を引き起こす[18][19]。その後、リン酸化されたFOXO1はユビキチン化され、プロテアソームによって分解される[20]。FOXO1のリン酸化は不可逆的であり、グルコース代謝と肝臓でのグルコース産生に対するインスリンの阻害効果を延長する。FOXO1のリン酸化によってグルコース-6-ホスファターゼの転写は低下し、その結果、糖新生とグリコーゲン分解の速度は低下する[21]。
FOXO1はグルコース-6-ホスファターゼの他に、ホスホエノールピルビン酸カルボキシキナーゼの転写も活性化する。この酵素は糖新生に必要である[22]。
FOXO1の活性はCBPによって誘導される、 Lys242、Lys245、Lys262に対するアセチル化によっても調節されている[23]。これらのリジン残基はDNA結合ドメインに位置しており、アセチル化によってFOXO1-DNA複合体の安定性が低下し、FOXO1のグルコース-6-ホスファターゼのプロモーターとの相互作用が阻害される。さらに、このアセチル化はAktによるSer253のリン酸化率を増加させる。Ser253のアラニンへの変異によって、FOXO1は恒常的に活性化状態となる。SIRT1はこのアセチル化を除去するが、SIRT1がFOXO1を脱アセチル化する正確な機構は研究中である。アセチル化は、FOXO1の転写活性を緩和することで、インスリン/PI3K経路とは独立した新たなレベルでの代謝制御を行うと考えられている[24]。
アポトーシス[編集]
FOXO1はAKTによってリン酸化されて阻害されるため、アポトーシスに重要な役割を果たしている可能性がある[25]。ヒトLNCaP前立腺がん細胞では、FOXO1の過剰発現はアポトーシスを引き起こす[25]。また、FOXO1はTRAILを調節する。ヒト前立腺がん細胞株LAPC4でFOXO1をアデノウイルスを用いて過剰発現した場合、TRAILはFOXO1誘発性のアポトーシスを引き起こす[25]。FOXO1はFasリガンドの転写をアップレギュレーションすることでも、アポトーシスによる細胞死をもたらす[25]。さらに、FOXO1はBcl-2ファミリーのメンバーであるBimをトランス活性化し、Bimはミトコンドリアのアポトーシス経路に関与してアポトーシスを促進する[25]。FOXO1がsiRNAによってサイレンシングされた場合、p53欠損細胞と機能細胞の双方でDNA損傷による細胞死が減少することが明らかにされている[25]。2型糖尿病の膵臓では、通常インスリンを産生しているβ細胞がアポトーシスを起こすため、インスリン産生が大きく低下する。β細胞の脂肪酸はFOXO1を活性化し、β細胞のアポトーシスをもたらす[26]。
細胞周期の調節[編集]
FOXO1の活性化は細胞周期の進行の調節に関与している。サイクリン依存性キナーゼ阻害因子であるp27KIP1の転写や半減期は、FOXO1が活性化されている場合に増加する。ブタの顆粒膜細胞では、FOXO1はp27KIP1の核局在を調節し、細胞周期の進行に影響を与えることが見いだされている。さらに哺乳類では、FOXO1を介した細胞周期の停止はサイクリンD1とサイクリンD2の抑制と関連付けられている。ヒトのFOXO1はサイクリンD1のプロモーター領域に結合することがChIPアッセイによって示されている。典型的なフォークヘッド転写因子応答エレメントに結合してp27KIP1の発現を誘導することができないヒトFOXO1のH215R変異体も、サイクリンD1とサイクリンD2のプロモーター活性を抑制することでG1期での細胞周期の停止を促進することができる。このように、FOXO1の活性化は遺伝子の転写の促進や抑制を通じて細胞周期をG1期で停止させる[25]。
作用機序[編集]
非リン酸化状態のFOXO1は核に局在し、そこでグルコース-6-ホスファターゼのプロモーターに位置するインスリン応答配列に結合して転写率を増加させる。FOXO1は、グルコース-6-ホスファターゼの転写の増加を通して、間接的に肝臓のグルコース産生速度を増加させる[22]。しかし、AktによってThr24、Ser256、Ser319がリン酸化されると、FOXO1は核から除去され、その後ユビキチン化されて分解される。AktによるFOXO1のリン酸化はグルコース-6-ホスファターゼの転写の減少を介して肝臓のグルコース産生を低下させる。
調節[編集]
FOXO1の活性は、アセチル化、リン酸化、ユビキチン化による調節が行われる[27]。
リン酸化[編集]
FOXO1のリン酸化はPI3K/AKT経路の活性化によるものである[27]。また、SGK1もFOXO1をリン酸化して不活性化することができる[25]。FOXO1はAKT/SGK1によるリン酸化によって核から細胞質へ移行し、不活性化される[27]。FOXO1はAKT/SGK1によってThr24、Ser256、Ser319の3か所が直接リン酸化される[28]。さらに、AKT/SGK1によるSer256のリン酸化はDNA結合ドメインの電荷を正電荷から負電荷へ変化させるため、FOXO1はDNAとの相互作用を喪失する[27]。
インスリンシグナル伝達カスケードのIRS1とIRS2もAKTのリン酸化を介してFOXO1を調節する[27]。AKTはFOXO1をリン酸化して細胞質へ蓄積させる[27]。成長因子によって活性化されるプロテインキナーゼであるカゼインキナーゼ1もFOXO1をリン酸化して細胞質へ移行させる[27]。
研究[編集]
FOXO1はインスリンによる転写と代謝の制御を関連付ける因子であるため、2型糖尿病の遺伝的制御の標的となる可能性がある。インスリン抵抗性マウスモデルでは、インスリン感受性の喪失のために肝臓でのグルコース産生が増加しており、通常のマウスと比較して肝臓での糖新生とグリコーゲン分解が加速しているが、これはおそらくFoxo1が調節を受けないためである。同じ実験をFoxo1ハプロ不全型マウスで行った場合、インスリン感受性は部分的に回復し、肝臓でのグルコース産生は低下する[29]。同様に、高脂肪食で飼育されたマウスでは、骨格筋と肝細胞でインスリン抵抗性の増加がみられる。しかし、Foxo1ハプロ不全型マウスを同じ高脂肪食で飼育した場合、骨格筋と肝細胞の双方で顕著なインスリン抵抗性の低下がみられる。この効果は一般的に処方される抗糖尿病薬であるロシグリタゾンを同時に投与することで大幅に増大する[30]。これらの結果は、2型糖尿病におけるインスリン脱感作の緩和に向けた、遺伝子治療に基づく新たなアプローチの可能性を示している。
糖尿病(1型と2型の双方)においては、腎臓での糖新生が通常時よりも血糖値に大きく寄与している[31]。インスリンによるFOXO1の抑制を高めることで、肝臓と腎臓の双方での糖新生を低下させることができる[31]。
高脂肪食で飼育されたマウスでは、Foxo1とNotch-1のハプロ不全の組み合わせによって、Foxo1のハプロ不全単独の場合よりもより効果的にインスリン感受性が回復する[32]。
成体組織から単離された腸管幹細胞から作り出された腸オルガノイドでは、FOXO1の阻害によってインスリン産生細胞を作り出すことができる[33]。
臨床的意義[編集]
- この遺伝子のPAX3遺伝子座への転座は、胞巣型横紋筋肉腫と関係している[5][34]。
- 糖新生において、FOXO1遺伝子は肝臓でのグルコース産生を低下させることにより、グルコースレベルを調節している[27]。マウスでは、糖新生遺伝子の発現を抑制することで、空腹時血糖を低下させている[27]。
- FOXO1は酸化ストレスからの細胞の保護に関与している[27]。糖尿病の合併症と関係して組織内で酸化ストレスが高まった場合には、細胞死を促進しているようである[27]。このような状況では、FOXO1は保護的ではなく破壊的な役割を果たす[27]。
- マウスでは、Foxo1はケラチノサイトの応答と機能を調整することで酸化ストレスを低下させ、創傷治癒を補助する[27]。創傷治癒は非常に複雑な生物学的過程であるが、FOXO1はケラチノサイトの治癒過程を促進するイベントの統合を補助している[35]。創傷治癒中のケラチノサイトでは、FOXO1の核局在は4倍に増加している[35]。また、FOXO1は成長因子をアップレギュレーションすることで、ケラチノサイトの移動を促進する[35]。
- 自然免疫系では、FOXO1はいくつかの炎症促進遺伝子の発現を増加させることで炎症を亢進させることが示されている[27]。FOXO1は高血糖値、TNFやLPSによる刺激に応答した炎症性サイトカインの発現を媒介する[27]。
- 獲得免疫系では、FOXO1はL-セレクチンのアップレギュレーションによって末梢B細胞のホーミングを調節し、末梢B細胞のクラススイッチを調節する。T細胞では、CD8+メモリーT細胞の生存を高める[27]。
- 発がんにおいては、FOXO1はがん抑制因子としての役割を果たしており、その不活性化はヒトの多くの種類のがんで確認されている[27]。FOXO1は、前立腺がんや神経膠腫の細胞において、アポトーシス促進因子をアップレギュレーションすることでアポトーシスを誘導し、腫瘍細胞の生存を抑制する[27]。FOXO1の活性化の増大は、遊走や浸潤を抑制したり、RUNX2の転写活性を抑制したりすることで、前立腺がん細胞の他の器官への転移を阻害する可能性がある[27]。
相互作用[編集]
FOXO1は次に挙げる因子と相互作用することが示されている。
出典[編集]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000150907 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000044167 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b “Fusion of a fork head domain gene to PAX3 in the solid tumour alveolar rhabdomyosarcoma”. Nature Genetics 5 (3): 230–5. (November 1993). doi:10.1038/ng1193-230. PMID 8275086.
- ^ “The forkhead transcription factor Foxo1 regulates adipocyte differentiation”. Developmental Cell 4 (1): 119–29. (January 2003). doi:10.1016/S1534-5807(02)00401-X. PMID 12530968.
- ^ “Phosphorylation of the transcription factor forkhead family member FKHR by protein kinase B”. The Journal of Biological Chemistry 274 (24): 17179–83. (June 1999). doi:10.1074/jbc.274.24.17179. PMID 10358075.
- ^ “Phosphorylation of serine 256 by protein kinase B disrupts transactivation by FKHR and mediates effects of insulin on insulin-like growth factor-binding protein-1 promoter activity through a conserved insulin response sequence”. The Journal of Biological Chemistry 274 (24): 17184–92. (June 1999). doi:10.1074/jbc.274.24.17184. PMID 10358076.
- ^ “The forkhead transcription factor Foxo1: a possible link between obesity and insulin resistance”. Molecular Cell 11 (1): 6–8. (January 2003). doi:10.1016/S1097-2765(03)00003-0. PMID 12535515.
- ^ “FOXO1 represses peroxisome proliferator-activated receptor-gamma1 and -gamma2 gene promoters in primary adipocytes. A novel paradigm to increase insulin sensitivity”. The Journal of Biological Chemistry 281 (29): 19881–91. (July 2006). doi:10.1074/jbc.M600320200. PMID 16670091.
- ^ “Insulin-regulated hepatic gluconeogenesis through FOXO1-PGC-1alpha interaction”. Nature 423 (6939): 550–5. (May 2003). doi:10.1038/nature01667. PMID 12754525.
- ^ “The forkhead transcription factor FoxO1 regulates proliferation and transdifferentiation of hepatic stellate cells”. Gastroenterology 132 (4): 1434–46. (April 2007). doi:10.1053/j.gastro.2007.01.033. PMID 17408630.
- ^ “Entrez Gene: FOXO1 forkhead box O1 (rhabdomyosarcoma)”. 2021年10月10日閲覧。
- ^ “FOXO1 is an essential regulator of pluripotency in human embryonic stem cells”. Nature Cell Biology 13 (9): 1092–9. (July 2011). doi:10.1038/ncb2293. PMC 4053529. PMID 21804543.
- ^ “Discovery of novel forkhead box O1 inhibitors for treating type 2 diabetes: improvement of fasting glycemia in diabetic db/db mice”. Molecular Pharmacology 78 (5): 961–70. (November 2010). doi:10.1124/mol.110.065714. PMID 20736318.
- ^ “FoxO1 is required for the regulation of preproglucagon gene expression by insulin in pancreatic alphaTC1-9 cells”. The Journal of Biological Chemistry 281 (51): 39358–69. (December 2006). doi:10.1074/jbc.M605022200. PMID 17062568.
- ^ “Transcription factor FoxO1 mediates glucagon-like peptide-1 effects on pancreatic beta-cell mass”. Diabetes 55 (5): 1190–6. (May 2006). doi:10.2337/db05-0825. PMID 16644672.
- ^ “Two novel phosphorylation sites on FKHR that are critical for its nuclear exclusion”. The EMBO Journal 21 (9): 2263–71. (May 2002). doi:10.1093/emboj/21.9.2263. PMC 125977. PMID 11980723.
- ^ “Roles of the forkhead in rhabdomyosarcoma (FKHR) phosphorylation sites in regulating 14-3-3 binding, transactivation and nuclear targetting”. The Biochemical Journal 354 (Pt 3): 605–12. (March 2001). doi:10.1042/0264-6021:3540605. PMC 1221692. PMID 11237865.
- ^ “Insulin-induced phosphorylation of FKHR (Foxo1) targets to proteasomal degradation”. Proceedings of the National Academy of Sciences of the United States of America 100 (20): 11285–90. (September 2003). doi:10.1073/pnas.1934283100. PMC 208749. PMID 13679577.
- ^ “FOXO transcription factors in the regulatory networks of longevity”. Journal of Biochemistry 141 (6): 769–74. (June 2007). doi:10.1093/jb/mvm104. PMID 17569704.
- ^ a b “The forkhead transcription factor Foxo1 (Fkhr) confers insulin sensitivity onto glucose-6-phosphatase expression”. The Journal of Clinical Investigation 108 (9): 1359–67. (November 2001). doi:10.1172/JCI12876. PMC 209440. PMID 11696581.
- ^ “Acetylation of Foxo1 alters its DNA-binding ability and sensitivity to phosphorylation”. Proceedings of the National Academy of Sciences of the United States of America 102 (32): 11278–83. (August 2005). doi:10.1073/pnas.0502738102. PMC 1183558. PMID 16076959.
- ^ “SIRT2 regulates adipocyte differentiation through FoxO1 acetylation/deacetylation”. Cell Metabolism 6 (2): 105–14. (August 2007). doi:10.1016/j.cmet.2007.07.003. PMC 2083635. PMID 17681146.
- ^ a b c d e f g h “FOXO1: a potential target for human diseases”. Current Drug Targets 12 (9): 1235–44. (August 2011). doi:10.2174/138945011796150280. PMC 4591039. PMID 21443466.
- ^ “Death versus dedifferentiation: The molecular bases of beta cell mass reduction in type 2 diabetes”. Seminars in Cell and Developmental Biology 103: 76–82. (2019). doi:10.1016/j.semcdb.2019.12.002. PMID 31831356.
- ^ a b c d e f g h i j k l m n o p q r s “FOXO transcription factors: their clinical significance and regulation”. BioMed Research International 2014: 925350. (April 2014). doi:10.1155/2014/925350. PMC 4016844. PMID 24864265.
- ^ “FOXO transcription factors throughout T cell biology”. Nature Reviews. Immunology 12 (9): 649–61. (September 2012). doi:10.1038/nri3278. PMC 3875397. PMID 22918467.
- ^ “Regulation of insulin action and pancreatic beta-cell function by mutated alleles of the gene encoding forkhead transcription factor Foxo1”. Nature Genetics 32 (2): 245–53. (October 2002). doi:10.1038/ng890. PMID 12219087.
- ^ “FoxO1 haploinsufficiency protects against high-fat diet-induced insulin resistance with enhanced peroxisome proliferator-activated receptor gamma activation in adipose tissue”. Diabetes 58 (6): 1275–82. (June 2009). doi:10.2337/db08-1001. PMC 2682681. PMID 19289458.
- ^ a b “Molecular signaling mechanisms of renal gluconeogenesis in nondiabetic and diabetic conditions”. Journal of Cellular Physiology 234 (6): 8134–8151. (2019). doi:10.1002/jcp.27598. PMID 30370538.
- ^ “Inhibition of Notch signaling ameliorates insulin resistance in a FoxO1-dependent manner”. Nature Medicine 17 (8): 961–7. (July 2011). doi:10.1038/nm.2378. PMC 3387563. PMID 21804540.
- ^ “FOXO1 inhibition yields functional insulin-producing cells in human gut organoid cultures”. Nature Communications 5: 4242. (June 2014). doi:10.1038/ncomms5242. PMC 4083475. PMID 24979718.
- ^ “PAX3-FOXO1 fusion gene in rhabdomyosarcoma”. Cancer Letters 270 (1): 10–8. (October 2008). doi:10.1016/j.canlet.2008.03.035. PMC 2575376. PMID 18457914.
- ^ a b c “Impact of Diabetes on the Protective Role of FOXO1 in Wound Healing”. Journal of Dental Research 94 (8): 1025–6. (August 2015). doi:10.1177/0022034515586353. PMC 530387. PMID 25978971.
- ^ “AKT-independent protection of prostate cancer cells from apoptosis mediated through complex formation between the androgen receptor and FKHR”. Molecular and Cellular Biology 23 (1): 104–18. (January 2003). doi:10.1128/MCB.23.1.104-118.2003. PMC 140652. PMID 12482965.
- ^ “Ligand-dependent interaction of estrogen receptor-alpha with members of the forkhead transcription factor family”. The Journal of Biological Chemistry 276 (36): 33554–60. (September 2001). doi:10.1074/jbc.M105555200. PMID 11435445.
- ^ “DAF-16 recruits the CREB-binding protein coactivator complex to the insulin-like growth factor binding protein 1 promoter in HepG2 cells”. Proceedings of the National Academy of Sciences of the United States of America 97 (19): 10412–7. (September 2000). doi:10.1073/pnas.190326997. PMC 27038. PMID 10973497.
- ^ “Interaction of FoxO1 and TSC2 induces insulin resistance through activation of the mammalian target of rapamycin/p70 S6K pathway”. The Journal of Biological Chemistry 281 (52): 40242–51. (December 2006). doi:10.1074/jbc.M608116200. PMID 17077083.
外部リンク[編集]
- FOXO1A protein, human - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)