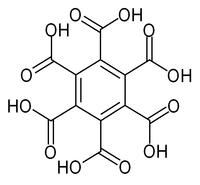
メリト酸
| メリト酸[1] | |
|---|---|
| |

| |
ベンゼン-1,2,3,4,5,6-ヘキサカルボン酸 | |
別称 黒鉛酸、メリット酸 | |
| 識別情報 | |
| CAS登録番号 | 517-60-2 |
| ChemSpider | 2244 |
| |
| 特性 | |
| 化学式 | C12H6O12 |
| モル質量 | 342.16 g/mol |
| 密度 | 1.68 g/cm3, 2.078 (calc.)[2] |
| 融点 |
>300 °C |
| 沸点 |
678 °C (calc.)[2] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
メリト酸(メリトさん、mellitic acid)は、黒鉛酸(こくえんさん、graphitic acid)、あるいはベンゼンヘキサカルボン酸(benzene hexacarboxylic acid)とも呼ばれる芳香族性を持ったカルボン酸の1種である。ベンゼンの水素が全てカルボキシ基に置換された構造をしている。
概要[編集]
メリト酸は、化学式 C6(CO2H)6 で表される。マルティン・ハインリヒ・クラプロートによって、1799年に蜜蝋石(ハニーストーン、メライト…組成式 Al2C6(COO)6·16H2O)という鉱物からアルミニウム塩として見出された。
蜜蝋石を炭酸アンモニウムと共に加熱し、過剰のアンモニウム塩を蒸発させて除き、アンモニアを加えるとメリト酸アンモニウムが得られる。沈殿したアルミナを濾別してから濾液を蒸発させ、再結晶する。次に酢酸鉛(II) を加えて鉛塩とし、さらに硫化水素で分解すると、遊離のメリト酸が得られる。純粋な炭素、あるいはヘキサメチルベンゼンを過マンガン酸カリウムの冷アルカリ性溶液や熱濃硝酸で酸化することによっても合成できる[3][4]。
繊維状の細かい針状結晶で、水やアルコールに溶ける。非常に安定な化合物であり、塩素、濃硝酸、塩酸とは反応を起こさない。加熱すると二酸化炭素とピロメリト酸 (C6H2(CO2H)4-1,2,4,5) に分解する。石灰と共に熱すると二酸化炭素とベンゼンに分解する。過剰量の五塩化リンを共存させて長期間放置すると酸塩化物になり、これは融点 190 ℃ の針状結晶である。アンモニウム塩を 150–160 ℃ に加熱するとアンモニアの遊離と共に反応が起こり、パラミド(メリミド)、C6(CONH)3、アンモニウムユークロアート (ammonium euchroate) の混合物が生成する。この混合物はアンモニウムユークロアートを水に溶解させることによって分離できる。パラミドは白色の不定形粉末で、水やアルコールに溶けない。
無水物[編集]
無水メリト酸 (C6(C2O3)3) は、一酸化炭素、二酸化炭素などと同様に炭素と酸素だけで構成される物質である。
脚注[編集]
- ^ MSDS for mellitic acid
- ^ a b Curate Data: Predicted Properties: 2244. ChemSpider.com.
- ^ Schulze, F. "Einwirkung des Schwefels auf Benzol". Chem. Ber. 1871, 4, 33–34.
- ^ Friedel, C.; Crafts, J. M. Ann. Chim. Phys. 1884 6, 470.
参考文献[編集]
 この記事にはアメリカ合衆国内で著作権が消滅した次の百科事典本文を含む: Chisholm, Hugh, ed. (1911). "Mellitic Acid". Encyclopædia Britannica (英語). Vol. 18 (11th ed.). Cambridge University Press. p. 95.
この記事にはアメリカ合衆国内で著作権が消滅した次の百科事典本文を含む: Chisholm, Hugh, ed. (1911). "Mellitic Acid". Encyclopædia Britannica (英語). Vol. 18 (11th ed.). Cambridge University Press. p. 95.
