スタチン
スタチン (Statin)、またはHMG-CoA還元酵素阻害薬は、HMG-CoA還元酵素の働きを阻害することによって、血液中のコレステロール値を低下させる薬物の総称である。
1973年に日本の遠藤章らによって最初のスタチンであるメバスタチンが発見されて以来、様々な種類のスタチンが開発され、高コレステロール血症の治療薬として世界各国で使用されている。近年の大規模臨床試験により、スタチンは高脂血症患者での心筋梗塞や脳血管障害の発症リスクを低下させる効果があることが明らかにされている。
歴史
発見

1971年、三共(現:第一三共)の発酵研究所に所属(当時)していた遠藤章のグループは、HMG-CoA還元酵素を阻害する物質の研究を開始した。HMG-CoA還元酵素はメバロン酸の合成に必要な酵素であり、メバロン酸は菌類の細胞膜・細胞骨格構成成分の重要な素材であることから、自己防衛手段としてこの酵素を阻害する物質を持つ微生物が存在するのではないかと彼らは考えたのである[1]。
1973年、6,000種に及ぶ微生物を検索した結果、遠藤らはアオカビの一種 (Penicillium citrinum) から最初のHMG-CoA還元酵素阻害薬であるメバスタチンを発見した[2]。彼らはメバスタチンの構造やHMG-CoA還元酵素を阻害するメカニズムについて解析すると共に、実際に血中のコレステロール値を低下させることができるかどうか、動物実験による検討を行った。ラット・マウスなど齧歯類では再現性のあるデータを得られなかったものの、ニワトリやイヌ、そしてより人間に近いサルでは血中コレステロール値は20-50%程度低下し、メバスタチンの効果を実証することに成功した[3][4]。
製品化

ヒトの脂質異常症患者や健康なボランティアを対象にした小規模試験においてもメバスタチンの有効性が示され、1979年に日本国内での臨床試験が開始された。しかし、長期高濃度投与実験を行っていたイヌで副作用が発生したことを受け、臨床試験は1年余りで中止となった[1]。
一方、メバスタチンの効果に関心を寄せていたアメリカの大手製薬企業・メルク(MSD)は、遠藤からサンプルやデータの提供を受けながら独自に研究開発を進めた結果、コウジカビの一種 (Aspergillus terreus) から新たなスタチンであるロバスタチンを分離することに成功した[1]。
その後の臨床試験で、ロバスタチンは安全性が比較的高く、メバスタチンと同程度のコレステロール低下作用を持つことが示された[5]。1987年、アメリカ食品医薬品局(FDA)から医薬品としての認可を受け、ロバスタチンは製品化された最初のスタチンとなった[6]。
高コレステロール血症は(心血管障害・脳血管障害を導く)動脈硬化症の主要なリスク要因の一つと考えられている[7]。スタチンの発見は、高コレステロール血症と関連疾患の予防、および基礎研究に多大な進歩をもたらした。遠藤と共同研究を行い、コレステロールの代謝・作用機序を解明したアメリカのマイケル・ブラウンとジョーゼフ・ゴールドスタインの2名に、1985年度のノーベル生理学・医学賞が贈られている。
遠藤もまた「スタチンの発見と開発」における一連の業績により、2006年の日本国際賞、さらに2008年には「アメリカのノーベル医学生理学賞」とも言われるラスカー賞(臨床医学研究部門)を受賞した[8]。日本では、東海大学内科助教授(当時)中谷矩章、京都大学老年科教授(当時)北徹、金沢大学内科助教授(当時)馬渕宏らにより、1989年にプラバスタチン(商品名メバロチン)が製品化された。
後発品
アトルバスタチンの基本特許満了伴い、日本では2011年(平成23年)11月に後発医薬品が発売されたものの、先発医薬品の企業が保有する結晶形の特許回避が困難であり、大型製品であるにもかかわらず、5社(うち2社は同一のもの)のみであった。
作用機序
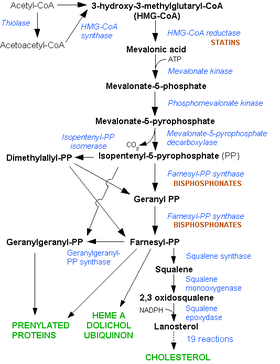
体内に吸収されたスタチンは、主に肝臓に分布する。スタチンはメバロン酸経路の律速酵素であるHMG-CoA還元酵素の働きを阻害することで、肝臓でのコレステロール生合成を低下させる。その結果、コレステロール恒常性維持のため肝臓でのLDL受容体発現が上昇し、血液から肝臓へのLDLコレステロールの取り込みが促進される[9]。LDLは一般に「悪玉コレステロール」と呼ばれ、血管壁にアテロームを形成して動脈硬化症の原因となる。コレステロール生合成の抑制が持続することにより、血液中へのVLDL(主にコレステロールとトリグリセリドからなるリポ蛋白)分泌も低下するため、血漿トリグリセリド値も低下する。
有効性
スタチンは冠動脈疾患のリスクを25%から40%あるいはそれ以上に低下させるが、冠動脈疾患のリスクの85%は食事が要因である[10]。しかし、糖尿病患者には心疾患予防効果は認められず[11]、さらに新規糖尿病患者が増加するとの報告がある[12]。
副作用
スタチンの投与によってみられる副作用には、頭痛・眠気・不眠症・筋肉痛[13]・腹痛・発疹・倦怠感などのほかに、重篤なものとして横紋筋融解症・末梢神経障害・ミオパシー・肝機能障害・血小板減少・心不全の発症・動脈硬化症などがある。このうち横紋筋融解症は急激な腎障害を伴うことがあるため、投与時にはクレアチンキナーゼやミオグロビンなど筋原酵素の動態に注意を払う必要がある。アルコール中毒者や肝臓障害者および既往歴のある者や甲状腺機能低下症の患者は高リスク群となる[14]。
高用量のスタチンを処方した場合、急性腎障害による入院率が上昇するとの報告がある[15]。
相互作用
- 脂質降下薬の1種であるフィブラート系薬剤とスタチンを併用すると、横紋筋融解症の発生リスクが高まることが知られており、これら2剤の併用は、原則禁忌になっている。2001年にはセリバスタチンとゲムフィブロジル製剤を併用した症例で、高頻度に横紋筋融解症が発生することが報告され、セリバスタチン製剤の自主回収が行われた[16]。
- スタチンはビタミンK2生合成に関わっている酵素(UBIAD1)を阻害するとの報告がある[17]。
- 2018年10月16日付け厚生労働省医薬・生活衛生局医薬安全対策課長名で[原則禁忌]の項の「腎機能に関する臨床検査値に異常が認められる患者に、本剤とHMG-CoA還元酵素阻害薬を併用する場合には、治療上やむを得ないと判断される場合にのみ併用すること。」を削除し、[重要な基本的注意]の項に「腎機能に関する臨床検査値に異常が認められる患者に、本剤とHMG-CoA還元酵素阻害薬を併用する場合には、治療上やむを得ないと判断される場合にのみ併用すること。急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。やむを得ず併用する場合には、本剤を少量から投与開始するとともに、定期的に腎機能検査等を実施し、自覚症状(筋肉痛、脱力感)の発現、CK(CPK)上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。」を追記し、[相互作用]の「原則併用禁忌」の項の「HMG-CoA還元酵素阻害薬(プラバスタチンナトリウム、シンバスタチン、フルバスタチンナトリウム等)」が削除された。[1]
適応症
一覧
メバスタチン(製品化されず)の発見以降、8種類のスタチンが日本および海外の製薬会社から医薬品として販売されている。
| 一般名 | 構造 | 主な商品名 | 製薬会社 | 備考 |
|---|---|---|---|---|
| ロスバスタチン(Rosuvastatin) | クレストール | 塩野義製薬/アストラゼネカ | - | |
| ピタバスタチン(Pitavastatin) |  |
リバロ | 興和創薬 | - |
| アトルバスタチン(Atorvastatin) |  |
リピトール(Lipitor) | ファイザー/アステラス製薬 | - |
| セリバスタチン(Cerivastatin) |  |
バイコール(Baycol)/セルタ | バイエル/武田薬品工業 | 副作用のため2001年以降各国で回収対象 |
| フルバスタチン(Fluvastatin) |  |
ローコール | ノバルティスファーマ/田辺三菱製薬 | - |
| シンバスタチン(Simvastatin) |  |
リポバス(Zocor) | メルク(MSD)/万有製薬(現:MSD) | - |
| プラバスタチン(Pravastatin) | 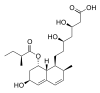 |
メバロチン(Pravachol) | 第一三共/ブリストル・マイヤーズ スクイブ | 製品化は1989年、後発医薬品あり |
| ロバスタチン(Lovastatin) |  |
メバコール | メルク(MSD) | 初めて製品化されたスタチン(1987年) |
| メバスタチン(Mevastatin) |  |
(未製品化) | - | 最初に発見されたスタチン(1973年) |
出典・脚注
- ^ a b c Endo A (1992). “The discovery and development of HMG-CoA reductase inhibitors” (PDF). J Lipid Res 33 (11): 1569–1582. PMID 1464741.
- ^ Endo A, Kuroda M, Tsujita Y (1976). “ML-236A, ML-236B, and ML-236C, new inhibitors of cholesterogenesis produced by Penicillium citrinum”. J Antibiot 29 (12): 1346-1348. PMID 1010803.
- ^ Tsujita Y, Kuroda M, Tanzawa K, Kitano N, Endo A (1979). “Hypolipidemic effects in dogs of ML-236B, a competitive inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A reductase”. Atherosclerosis 32 (3): 307-313. PMID 223590.
- ^ Kuroda M, Tsujita Y, Tanzawa K, Endo A (1979). “Hypolipidemic effects in monkeys of ML-236B, a competitive inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A reductase”. Lipids 14 (6): 585-589. PMID 110993.
- ^ The Lovastatin Study Group II (1986). “Therapeutic response to lovastatin (mevinolin) in nonfamilial hypercholesterolemia. A multicenter study”. JAMA 256 (20): 2829-2834. PMID 3534333.
- ^ Grundy SM (1988). “HMG-CoA reductase inhibitors for treatment of hypercholesterolemia”. NEJM 319 (1): 24-33. PMID 3288867.
- ^ Christians U, Jacobsen W, Floren LC (1998). “Metabolism and drug interactions of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors in transplant patients: are the statins mechanistically similar?”. Pharmacol Ther 80 (1): 1-34. PMID 9804052.
- ^ 2006年(第22回)日本国際賞受賞者「治療技術の開発と展開」分野 - 財団法人国際科学技術財団
- ^ Ma PT, Gil G, Südhof TC, Bilheimer DW, Goldstein JL, Brown MS (1986). “Mevinolin, an inhibitor of cholesterol synthesis, induces mRNA for low density lipoprotein receptor in livers of hamsters and rabbits”. Proc Natl Acad Sci USA 83 (21): 8370–8374. PMID 3464957.
- ^ “Dietary cholesterol and egg yolks: not for patients at risk of vascular disease”. Can J Cardiol 26 (9): e336–9. (2010). PMC 2989358. PMID 21076725.
- ^ 奥山治美、浜崎智仁、大櫛陽一 ほか、糖尿病者にスタチンは禁忌-緊急提言 脂質栄養学 22巻 (2013) 2号 p.173-186, doi:10.4010/jln.22.173
- ^ 内藤亮、宮内克己、「脂質異常症と動脈硬化」 medicina 52巻 1号 (2015) pp.94-97, doi:10.11477/mf.1402223030
- ^ Schmidt, Charlie (2019年1月7日). “Long-term statin use protects against prostate cancer death” (英語). Harvard Health Blog. 2021年1月26日閲覧。
- ^ HMG‐CoA還元酵素阻害剤 (PDF)
- ^ 大西淳子「強力なスタチン療法は急性腎障害による入院リスク上昇に関与」『日経メディカル オンライン』2013年4月8日、2013年4月10日閲覧。
- ^ Furberg CD, Pitt B (2001). “Withdrawal of cerivastatin from the world market”. Curr Control Trials Cardiovasc Med 2 (5): 205-207. PMID 11806796.
- ^ Functional Characterization of the Vitamin K2 Biosynthetic Enzyme UBIAD1. 10. (2015). doi:10.1371/journal.pone.0125737. PMC PMC4398444. PMID 25874989.
関連項目
外部リンク
以下の遺伝子、タンパク質、代謝はそれぞれの記事をリンクされている [§ 1]
- ^ この双方向伝達経路地図はWikiPathwaysで編集できる: “Statin_Pathway_WP430”. 2014年5月7日閲覧。


