六フッ化テクネチウム
| 六フッ化テクネチウム | |
|---|---|
| |
| 識別情報 | |
| CAS登録番号 | 13842-93-8 |
| 特性 | |
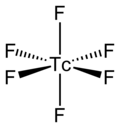
| 化学式 | TcF6 |
| モル質量 | 212 g/mol (98Tc) |
| 外観 | 黄金色結晶[1] |
| 密度 | 3,58 g/cm3 (-140 °C), 固体[2] |
| 融点 |
37.4 °C, 311 K, 99 °F [1] |
| 沸点 |
55.3 °C, 328 K, 132 °F [1] |
| 構造 | |
| 結晶構造 | 立方晶 |
| 危険性 | |
| EU分類 | not listed |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
六フッ化テクネチウム または フッ化テクネチウム(VI) は化学式 TcF6 で表される化合物で、黄色の低融点固体である。1961年に初めて単離された[3]。テクネチウムのハロゲン化物の中で最大の酸化数 +6 を取る(他には六塩化テクネチウム TcCl6が知られている)。これにより七フッ化物ReF7を持つレニウムと分離することができる[4]。テクネチウムはウランの核分裂生成物であるため、ウラン精製時には六フッ化ウランに六フッ化テクネチウムが必然的に混入してしまう。
調製[編集]
六フッ化テクネチウムは400 ℃に熱した金属テクネチウムにフッ素を反応させることで生成する[3]。
物性[編集]
六フッ化テクネチウムは室温では黄金色の固体で、融点は37.4 ℃、沸点は55.3 ℃である[1]。
六フッ化テクネチウムは-4.54 ℃で相転移し、これ以上の温度では立方晶をとる。格子定数は a = 6.16 Åである。10 ℃のとき密度は3.02 g·cm-3となる。一方、転移温度以下では空間群Pnma の斜方晶をとり、格子定数は a = 9.55 Å, b = 8.74 Å, and c = 5.02 Å である。-19 ℃のとき密度は3.38 g·cm-3となる。-140 ℃では斜方晶のまま格子定数が a = 9.360 Å, b = 8.517 Å, and c = 4.934 Å に変わり、密度は 3.58 g·cm-3になる[2]。
六フッ化テクネチウム分子は八面体型構造で、点群Oh に属し、テクネチウムとフッ素の結合長は 1.812 Åである[2]。磁気モーメントの測定値は0.45 μB である[5]。
性質[編集]
物理的性質[編集]
赤外分光法およびラマン分光法により、六フッ化テクネチウム分子は八面体型であることが知られている[6][7]。六フッ化ロジウム(RhF6)や六フッ化オスミウム(OsF6)といった他の金属六フッ化物と同様に低温では斜方晶で、室温で立方晶(体心立方格子)に変態する[8]。磁気モーメントの測定値として、d1八面体化合物における予想より低い0.45 µBが得られている[9]。
化学的性質[編集]
六フッ化テクネチウムは五フッ化ヨウ素(IF5)溶液中にアルカリ金属塩化物と共存させるとヘキサフルオロテクネチウム酸イオンを形成する[10][11]。 また、水酸化ナトリウム水溶液で加水分解すると不均化して酸化テクネチウム(IV)の黒色沈殿を生じる[3]。 フッ化水素酸溶液中でフッ化ヒドラジニウムと反応させると N2H6>TcF6 または N2H6(TcF6)2 が生じる[12]。
脚注[編集]
- ^ a b c d CRC Handbook of Chemistry and Physics, 90th Edition, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-93.
- ^ a b c Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). “Solid State Molecular Structures of Transition Metal Hexafluorides”. Inorganic Chemistry 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- ^ a b c Selig, H.; Chernick, C.L.; Malm, J.G. (1961). “The Preparation and Properties of TcF6”. J. Inorg. & Nuclear Chem. 19 (3-4): 377–381.
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ Henry Selig, Fred A. Cafasso, Dieter M. Gruen, John G. Malm: "Magnetic Susceptibility of ReF6", in: Journal of Chemical Physics, 1962, 36 (12), S. 3440–3444; doi:10.1063/1.1732477.
- ^ Howard H. Claassen, Henry Selig, and John G. Malm (1962). “Vibrational Spectra of MoF6 and TcF6”. J. Chem. Phys. 36 (11): 2888–2890. doi:10.1063/1.1732396.
- ^ Howard H. Claassen, Gordon L. Goodman, John H. Holloway, and Henry Selig (1970). “Raman Spectra of MoF6, TcF6, ReF6, UF6, SF6, SeF6, and TeF6 in the Vapor State”. J. Chem. Phys. 53 (1): 341–348. doi:10.1063/1.1673786.
- ^ Siegel S and Northrop D A (1966). “X-Ray Diffraction Studies of Some Transition Metal Hexafluorides”. Inorg. Chem. 5 (12): 2187–2188. doi:10.1021/ic50046a025.
- ^ Selig, H; Cafasso, F A.; Gruen, D M.; Malm, J G. (1962). “Magnetic Susceptibility of ReF6”. Journal of Chemical Physics 36 (12): 3440–3444. doi:10.1063/1.1732477.
- ^ Edwards, A. J.; Hugill, D.; Peacock, R. D. (1963). “New Fluorine Compounds of Technetium”. A. J. Edwards, D. Hugill & R. D. Peacock 200 (4907): 672. doi:10.1038/200672a0.
- ^ D. Hugill and R. D. Peacock (1966). “Some quinquevalent fluorotechnetates”. J. Chem. Soc. A: 1339–1341. doi:10.1039/J19660001339.
- ^ Frlec B, Selig H, and Hyman H.H (1967). “Hydrazinium(+2) Hexafluorometalates(IV) and -(V) in the 4d and 5d Transition Series”. Inorg Chem 6 (10): 1775–1783. doi:10.1021/ic50056a004.

