「RNA治療」の版間の差分
Advancemirror (会話 | 投稿記録) タグ: カテゴリを含まない記事の作成 |
(相違点なし)
|
2020年12月17日 (木) 11:15時点における版
RNA治療
RNA治療薬は、リボ核酸に基づく薬物のクラスであり、RNAとしても知られています。主なタイプは、メッセンジャーRNA(mRNA)、アンチセンスRNA、干渉RNA(RNAi)、およびRNAアプタマーです。
4つのタイプのうち、mRNAベースの治療法は細胞内のタンパク質合成のトリガーに基づく唯一のタイプであり、ワクチン開発に特に有用です[1]。mRNAワクチンは、SARSとの闘いに使用するために2020年CoV-2の世界的大流行に開発されました[2]。アンチセンスRNAはコーディングmRNAに相補的であり、mRNAの不活性化を引き起こしてmRNAがタンパク質翻訳に使用されるのを防ぐために使用されます[3]。 RNAiベースのシステムは同様のメカニズムを使用しており、mRNAの翻訳を防ぐために低分子干渉RNA(siRNA)とマイクロRNA(miRNA)の両方を使用します[4][5]。しかし、RNAアプタマーは、定向進化によって生成された短い一本鎖RNA分子であり、さまざまな生体分子標的に高い親和性で結合し、それによって通常のinvivo活性に影響を与えます[4][5] ただし、RNAアプタマーは、定向進化によって生成される短い一本鎖RNA分子であり、さまざまな生体分子ターゲットに高い親和性で結合し、それによって通常の「invivo」活性に影響を与えます[6][7][8]。
RNAは、DNA発現とタンパク質翻訳の間の中間生体分子として機能するメッセンジャーRNA(mRNA)を使用したRNAポリメラーゼによってテンプレートDNAから合成されます。その独特の特性(通常は一本鎖の性質や2'OH基など)と、多くの異なる二次/三次構造を採用する能力のために、ボットコーディングおよび非コーディングRNAは医学で特別な注目を集めています。研究は、治療上の利益のために使用される可能性のあるRNAの調査を開始し、創薬およびRNA治療の実施中に独自の課題が発生しました[9]。
mRNA
メッセンジャーリボ核酸(mRNA)は、遺伝子のDNA鎖の1つに相補的な一本鎖RNA分子です[10]。mRNA分子は、タンパク質を作るためにDNAコードの一部を細胞の他の部分に移します[11]。DNA治療薬は、RNAに転写されるために核へのアクセスを必要とし、その機能は細胞分裂中の核膜の破壊に依存します。しかし、mRNA治療薬は、細胞質に到達するとすぐに翻訳されるため、機能するために核に入る必要はありません[12]。さらに、プラスミドやウイルスベクターとは異なり、mRNAはゲノムに組み込まれないため、挿入型遺伝子変異のリスクがありません[13]。これらの理由により、mRNA治療薬は、癌ワクチン、腫瘍免疫療法、感染症予防など、さまざまな分野で使用されてきました[14]。
発見と開発
1953年、アルフレッド・デイ・ハーシーは、ファージに感染した直後に、バクテリアが高レベルのRNAを生成し、このRNAも急速に分解されたと報告しました[15]。しかし、mRNAの最初の明確な兆候は、1956年にE.ColiにT2バクテリオファージを感染させ、それらを32Pの培地に入れた、Elliot VolkinとLazarus Astrachanの研究によるものでした。彼らは、E.Coliのタンパク質合成が停止され、ファージタンパク質が合成されることを発見しました[16]。その後、1961年5月、共同研究者のシドニーブレナー、フランソワジャコブ、ジムワトソンがmRNAの単離を発表しました[17][18]。mRNAの発見後数十年間、人々はmRNAの構造的、機能的、代謝経路の側面を理解することに焦点を当てていました。しかし、1990年に、Jon A. Wolffは、注入された筋肉でコードされたタンパク質を発現するマウスの骨格筋にin vitro転写(IVT)mRNAまたはプラスミドDNA(pDNA)を直接注入することにより、核酸コード化薬物のアイデアを示しました[19][20]。
IVT mRNAが細胞質に到達すると、mRNAは即座に翻訳されます。したがって、機能するために核に入る必要はありません[21]。また、それはゲノムに組み込まれるため、挿入型遺伝子変異のリスクがありません[22]。さらに、IVT mRNAは一時的にのみ活性であり、生理学的代謝経路を介して完全に分解されます[23]。これらの理由により、IVTmRNAは広範な前臨床試験を受けています。
メカニズム
インビトロ転写(IVT)は、標的コード配列を含む線形化されたDNAプラスミドテンプレートで実行されます。次に、裸のmRNAまたはナノ粒子に複合体を形成したmRNAが全身的または局所的に送達されます。その後、外因性の裸のmRNAまたは複合体化されたmRNAの一部が細胞特異的なメカニズムを経ています。細胞質に入ると、IVTmRNAはタンパク質合成機構によって翻訳されます[24] [25] 。
2つの識別されたRNAセンサー、トール様受容体(TLR)とRIG-I様受容体ファミリーがあります。 TLRは、DCやマクロファージなどの細胞のエンドソームコンパートメントに局在しています[26]。RIG-I様ファミリーはパターン認識受容体(PRR)としてのものです[27] ただし、免疫応答のメカニズムと細胞センサーによるmRNAワクチン認識のプロセスとセンサーの活性化のメカニズムはまだ不明です[25] 。ただし、免疫応答のメカニズムと細胞センサーによるmRNAワクチン認識のプロセスとセンサーの活性化のメカニズムはまだ不明です[25] 。
アプリケーション
がん免疫療法
1995年、ロバート・コンリーは、癌胎児性抗原をコードする裸のRNAの筋肉内注射が抗原特異的抗体反応を誘発することを示した[28]。次に、特定の抗原をコードするmRNAまたは腫瘍細胞から抽出されて担癌マウスに注入された全mRNAに曝露された樹状細胞(DC)がT細胞免疫応答を誘導し、腫瘍の増殖を阻害することを実証することによって詳しく説明された[29]。その後、研究者らは、exvivoでのIVTmRNAをトランスフェクトしたDCに基づくワクチンを使用して、mRNAをトランスフェクトしたDCにアプローチし始めました[30]。一方、Argos Therapeuticsは2015年に進行性腎細胞癌を伴うDCを使用した第III相臨床試験を開始しましたが(NCT01582672)、有効性の欠如により終了しました[31]。
さらなる応用のために、IVTmRNAはinvivoでのDCのinsituトランスフェクション用に最適化されました。これにより、IVT mRNAの翻訳効率と安定性が向上し、MHCクラスIおよびII分子でのmRNAにコードされた抗原の提示が強化されました[32][33]。次に、彼らは、リンパ節への裸のIVT mRNAの直接注射が、T細胞応答を誘導するための最も効果的な方法であることを発見した[34]。この発見に基づいて、BioNTechによる癌抗原をコードする裸のIVT mRNAの注射のヒトでの最初の試験が、黒色腫の患者で開始された(NCT01684241)[35]。
最近、自己送達RNA(sd-rxRNA)と養子細胞移植(ACT)療法を組み合わせた新しい癌免疫療法が、RXiPharmaceuticalsとカロリンスカ研究所によって発明されました。この治療法では、sd-rxRNAは治療用免疫細胞における免疫抑制受容体とタンパク質の発現を排除したため、免疫細胞が腫瘍細胞を破壊する能力が向上しました。次に、PD-1を標的としたsd-rxRNAは、黒色腫細胞に対する腫瘍浸潤リンパ球(TIL)の抗腫瘍活性の増加を助けました[36][37]。この考えに基づいて、mRNA-4157はテストされ、第I相臨床試験に合格しました[38] 。
ワクチン
1993年に、mRNAワクチンの最初の成功は、ウイルス特異的T細胞を誘導したインフルエンザの核タンパク質をコードするリポソームカプセル化IVTmRNAを使用することによって報告されました[39]。次に、IVT mRNAは合成脂質ナノ粒子で処方され、マウスの呼吸器合胞体ウイルス(RSV)およびインフルエンザウイルスに対する防御抗体反応を誘発しました[40] 。
感染症のためのIVTmRNAベースのワクチン開発にはいくつかの異なるタイプがあります。成功したタイプの1つは、プラス鎖RNAウイルスの配列を持つ自己増幅IVTmRNAを使用することです。もともとはフラビウイルス用に開発されたもので、皮内注射で使用できました。他の方法の1つは、mRNAアジュバントとインフルエンザ血球凝集素抗原のみをコードする裸のIVT mRNAを含む、またはIVTmRNAをコードするノイラミニダーゼと組み合わせた2成分ワクチンを注射することです[41]。
たとえば、HIV治療の場合、ワクチンは、HIVタンパク質をコードするIVTmRNAでトランスフェクトされたDCを使用しています。 IVT mRNAをコードする組み合わせを使用したいくつかの第I相および第II相臨床試験があり、抗原特異的CD8+およびCD4+T細胞応答を誘導できることが示されています。しかし、臨床試験では抗ウイルス効果は観察されていません[42][43]。
他のmRNAワクチンの1つはCOVID19用です。 2019年12月に重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)が発生し、世界中に広がり、コロナウイルス病2019(Covid-19)と呼ばれる呼吸器疾患のパンデミックを引き起こしました[44]。Modernaによって製造されたmRNA-1273ワクチン候補は、脂質ナノ粒子(LNP)でカプセル化されたmRNAベースのワクチンであり、膜貫通アンカーを備えたSARS-CoV-2の完全長の融合前安定化スパイク(S)-2P抗原をコードします[45][46]。 2020年11月16日、Modernaは、COVID 19ワクチン候補mRNA-1273が、94.5%のワクチン有効性で第3相COVID19研究の最初の中間分析で主要な有効性エンドポイントを達成したと述べました[47]。
制限事項
mRNAは非常に大きくて重い分子(10 ^ 5〜10 ^ 6 Da)であるため、mRNAの薬物への翻訳を成功させるには多くの課題があります[48]。さらに、mRNAは不安定でヌクレアーゼによって容易に分解され、免疫系も活性化します[49]。さらに、mRNAは高い負電荷密度を持ち、細胞膜を通過するmRNAの浸透を減少させます[50]。これらの理由により、適切なデリバリーシステムがないと、mRNAは容易に分解され、デリバリーシステムがない場合のmRNAの半減期はわずか約7時間です[51]。化学修飾によってある程度の課題を克服できたとしても、mRNAの送達は依然として大きな障害として残っています。 mRNAの送達システムを改善するために研究されてきた方法は、マイクロインジェクション、RNAパッチ(溶解するマイクロニードルにロードされたmRNA)、遺伝子銃、プロタミン凝縮、RNAアジュバント、および脂質を含むナノ粒子へのmRNAのカプセル化を使用しています[48][52][53]。
送達剤を含むインビトロ翻訳(IVT)mRNAは分解に対する改善された耐性を示したが、インビボでの裸のmRNAの送達の効率を改善する方法についてのさらなる研究が必要である[20]。
アンチセンスRNA
アンチセンスRNAは、mRNAのコード配列に相補的な非コードおよび一本鎖RNAです。それはmRNAがタンパク質に翻訳される能力を阻害します[54]。短いアンチセンスRNA転写物は、二本鎖RNA前駆体を21〜26ヌクレオチド長のRNA種に切断する酵素ダイサーの作用によって核内で生成されます[3]。
アンチセンスベースの発見戦略、スクリーニングアッセイの理論的根拠および設計、ならびに天然物抽出物のスクリーニングおよび脂肪酸凝縮酵素阻害剤の発見のためのそのようなアッセイの適用が存在する[55]。アンチセンスRNAは、癌の治療と転移の阻害、およびアンチセンス隔離のためのベクターに使用されます。特に、癌の診断と予防のための治療を必要としている患者へのマイクロRNA(miR)15と16[56]のアンチセンス薬は、アンチセンスRNAがmRNAとハイブリダイズして不活性化するという事実に基づいています。これらの薬は、mRNAに付着し、特定の遺伝子がそれをコードするタンパク質を生成するのを阻止するRNAの短い配列です。アンチセンス薬は、肺がん、糖尿病、および主要な炎症成分を伴う関節炎や喘息などの疾患を治療するために開発されています[57]。これは、MLLT4アンチセンスRNA 1(MLLT4‑AS1)の発現低下が、潜在的なバイオマーカーであり、胃癌の予後不良の予測因子であることを示しています。これまでのところ、アンチセンスおよび抗癌治療、ならびに植物および微生物における関連遺伝子の発現の調節におけるアンチセンスRNAの応用が検討されてきた[58]。
アンチセンスRNAを細胞膜を介して細胞質および核に送達するために、非ウイルスベクター、レトロウイルスおよびアデノウイルスなどのウイルスベクター、ならびにリポソームが使用されてきた[59]。ウイルスベクターベースの送達は、トランスフェクション効率が高いため、異なる送達システムの中で最も有利であることがわかっています[60]。しかし、アンチセンスRNAを標的部位にのみ送達することは困難であり、アンチセンスRNAのサイズと安定性の問題のために、それを使用するにはいくつかの制限があります。送達の問題を改善するために、化学修飾、および新しいオリゴヌクレオチドの設計が研究されており、それは薬物分布、副作用、および忍容性を強化しました[61] [62]。
RNAi
干渉RNAは、遺伝子発現を翻訳的または翻訳後に抑制するように作用する短い非コードRNAのクラスです[63][4]。転写後遺伝子調節の重要なエフェクターとしての彼らの発見とその後の同定により、低分子干渉RNA(siRNA)とマイクロRNA(miRNA)が全身性疾患の潜在的な治療法となった[63][4][64]。RNAiシステムは1990年にペチュニアへの着色遺伝子の導入に関する研究を行っていたJorgensenらによって最初に発見され[64][65]、このシステムはもともと二本鎖RNAウイルスに対する自然免疫の手段として開発されたと考えられています[66]。
siRNA
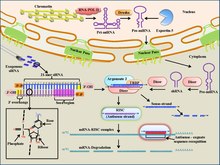
低分子干渉(siRNA)は短く、19〜23塩基対(2ヌクレオチドの3 'オーバーハング)、遺伝子サイレンシングのためのRNA誘導サイレンシング複合体(RISC)に関与するRNAの二本鎖断片です[4][64]具体的には、siRNAはRISC複合体に結合し、ATP加水分解を使用して巻き戻されます。[64][67][68]。具体的には、siRNAはRISC複合体に結合し、ATP加水分解を使用して巻き戻されます[64][67][68]。次に、酵素「スライサー」によるガイドとして使用され、ターゲットmRNAへの相補的な塩基対形成に基づいて分解のためにmRNAをターゲットにします[64][67][68]。治療薬として、siRNAは目や鼻を通して局所的に送達され、さまざまな疾患を治療することができます[4]。局所送達は、単純な製剤および薬物送達、ならびに薬物の高い生物学的利用能から利益を得る[4]。がんやその他の疾患を標的とするためには、全身送達が必要です[4]。局所的に送達されたときにsiRNAを標的にすることは、siRNA治療における主要な課題の1つです[4]。静脈内注射を使用してsiRNA療法を実施することは可能ですが、注射で使用される大量の場合、これらは総血液量の約20〜30%[64]でなければならないことが多いため、懸念が生じています。他の送達方法には、リポソーム包装、膜透過性ペプチドへの結合、および直接組織/臓器エレクトロポレーションが含まれる[64]。さらに、外因性siRNAはinvivoで数日(非分裂細胞では最大で数週間)しか持続しないことがわかっています[69][70]。siRNAがその標的にうまく到達できれば、mRNA標的と塩基対を形成し、RISCシステムを介してそれらの分解を促進する能力を通じて遺伝子発現を治療的に調節する可能性があります[4][64]現在、siRNAベースの治療法は加齢性黄斑変性症の治療のための第I相臨床試験で[64]、癌治療での使用も検討されています。たとえば、siRNAは、VEGF受容体やテロメラーゼ酵素などの腫瘍増殖を促進するタンパク質をコードするmRNAを標的とするために使用できます[64]。
miRNA
マイクロRNA(miRNA)は短く、マイクロRNA誘導サイレンシング複合体に関与する約19〜23塩基対の長鎖RNAオリゴヌクレオチドです[64][5]。具体的には、ARGONAUTE酵素にロードされると、miRNAはmRNAと連携して翻訳を抑制し、翻訳後にmRNAを不安定化します[5]。それらはsiRNAと機能的に類似していますが、miRNAはmRNAサイレンシングのために広範な塩基対を必要としません(ターゲットとのわずか7塩基対を必要とする場合があります)[71][72]、したがってそれらはより広い範囲のmRNAに広く影響を与えることができますターゲット[73]。細胞内では、miRNAはスイッチ、チューニング、ニュートラルな相互作用を使用して、遺伝子抑制を細かく調節します[5]。治療薬として、miRNAは生物全体の生化学的経路に影響を与える可能性があります[63]。
ヒトで400を超えるmiRNAが同定されているため、抑制の標的遺伝子を見極めることが最初の課題です[5]。miRNAシードマッチングを使用して、TargetScanなどの複数のデータベースが構築されています[63]。インビトロアッセイは、miRNAの表現型の影響を決定するのに役立ちますが[63]、遺伝子調節の複雑な性質のため、同定されたすべてのmiRNAが期待される影響を与えるわけではありません[5]。さらに、発癌性のmiR-155やmiR-17-92など、いくつかのmiRNAがinvivoで腫瘍抑制因子または癌遺伝子として作用することがわかっています[73]。
臨床試験では、miRNAはさまざまな疾患のバイオマーカーとして一般的に使用されており、疾患の進行、病期、および遺伝的関連だけでなく、早期診断を提供する可能性があります[63]。現在、第1相および第2相試験では、がんおよびその他の疾患の患者を対象に、miRNA模倣物(遺伝子を発現させるため)およびmiRNA(遺伝子を抑制するため)を試験している[63]。特に、模倣miRNAは腫瘍抑制因子として作用するmiRNAを癌性組織に導入するために使用され、miRNAアンタゴニストは発癌性miRNAを標的にして癌促進活性を防ぐために使用されます[73]。患者のmiRNAレベルを過剰発現または不安定化することが知られている一般的な治療法(がん治療法など)に加えて、治療用miRNAも使用されます[63]。マウス研究で肺がん腫瘍の増殖を阻害する効果を示した1つの模倣miRNA療法の例はmiR-34aです[73][74]。
miRNAベースの治療法の側面に関する1つは、外因性miRNAが正常な体細胞内のmiRNAサイレンシングメカニズムに影響を及ぼし、それによって正常な細胞生化学的経路に影響を与える可能性があることです[73]。しかし、in vivoの研究では、miRNAは非標的組織/臓器ではほとんどまたはまったく効果を示さないことが示されています[74][75]。
RNAアプタマー

概して、アプタマーは一本鎖DNAまたはRNAのいずれかで構成される小分子であり、通常、長さは20〜100ヌクレオチド[6][7][77]または約3〜60kDaです[77][78]。一本鎖の性質のため、アプタマーは、鎖内の塩基対相互作用を通じて、シュードノット、ステムループ、およびバルジを含む多くの二次構造を形成することができます[77]。アプタマーに存在する二次構造の組み合わせは、それに特定の三次構造を与え、それが次にアプタマーが選択的に結合する特定の標的を決定する[77][79]。アプタマーの選択的結合能力のために、彼らは医薬品で使用するための有望な生体分子を検討しています[6][7][77]。さらに、アプタマーは標的への緊密な結合を示し、解離定数はしばしばpMからnMの範囲にあります[6][8]。強力な結合能力に加えて、アプタマーは、ファージディスプレイまたは抗体によって生成された小さなペプチドによって結合することができないターゲットで使用でき、コンフォメーション異性体とアミノ酸置換を区別できるため、評価されます[77][80][81]。また、アプタマーは核酸ベースであるため、直接合成することができ、抗体産生の場合のように細胞ベースの発現および抽出の必要性を排除します[7][82]。特にRNAアプタマーは無数の異なる構造を生成することができ、DNAアプタマーと比較してそれらの標的親和性においてより識別力があるという推測につながります[77][83]。
発見と開発
アプタマーは、1990年にLaryGoldとCraigTuerkがSELEXとして知られる定向進化の方法を利用して、T4バクテリオファージDNAポリメラーゼに結合できる小さな一本鎖RNA分子を単離したときに最初に発見されました[7][84]。さらに、「アプタマー」という用語は、ジャック・ショスタクと協力して特定の有機色素分子に緊密に結合できるRNAアプタマーを選択したAndrewEllingtonによって造られました[77][85]。用語自体は、ラテン語の「aptus」または「to fit」と、ギリシャ語の「meros」または「part」の集合体です[77][85]。
RNAアプタマーは「選択」されるほど「作成」されません。分子標的に選択的に結合できるRNAアプタマーを開発するために、指数関数的濃縮によるリガンドの系統的進化(SELEX)として知られる方法を使用して、約10 ^ 13から10 ^ 16の異なるアプタマーのプールからユニークなRNAアプタマーを単離します。別名ライブラリーとして知られています[6][7][77][84][85]。次に、潜在的なアプタマーオリゴヌクレオチドのライブラリーを非標的種とインキュベートして、非特異的結合を示すアプタマーを除去します[6]。その後、非特異的アプタマーを除去した後、残りのライブラリーメンバーは、タンパク質、ペプチド、細胞タイプ、さらには臓器(生きている動物ベースのSELEXの場合)などの目的のターゲットにさらされます[6][77][86][87][88][89][90][91]。そこから、標的に結合したRNAアプタマーはcDNAに転写され、cDNAはPCRによって増幅され、PCR産物はRNAに再転写されます[77]。次に、これらの新しいRNA転写産物を使用して、選択サイクルを何度も繰り返し、最終的には、特異性が高く、親和性の高いターゲット結合が可能なRNAアプタマーの均一なプールを生成します[6]。
例
RNAアプタマーは、アンタゴニスト、アゴニスト、またはいわゆる「RNAデコイアプタマー」として機能するように設計することができます[77][92]。アンタゴニストの場合、RNAアプタマーは、特定のタンパク質の細胞への結合を防ぐために使用されます。膜受容体またはタンパク質の標的に結合することによってタンパク質がその活性を発揮するのを防ぐ[77]。現在、臨床試験に進んだ唯一のRNAアプタマーベースの治療法がアンタゴニストとして作用する[77]。 RNAアプタマーが作用するように設計されている場合アゴニストとして、それらは共刺激分子として免疫細胞の活性化を促進し、それにより体自身の防御システムの動員を助ける[77][93]。RNAデコイアプタマーの場合、合成RNAアプタマーは天然RNA分子に似ている[77][92]。そのため、ネイティブRNAターゲットに結合するタンパク質は、代わりにRNAアプタマーに結合し、特定の疾患の生体分子経路を妨害する可能性があります[77][92]。直接治療としての有用性に加えて、エージェント、RNAアプタマーも他の人のために検討されています治療上の役割。たとえば、RNAアプタマーを薬物化合物に結合させることにより、RNAアプタマーはその薬物の標的化送達システムとして機能することができます[6]。このようなRNAアプタマーはApDCとして知られています[6]。さらに、放射性同位元素または蛍光色素分子への結合を通じて、RNAアプタマーは画像診断に役立つ可能性があります[6][94][95] 。
RNAアプタマーを選択するために利用されるSELEXプロセスのために、RNAアプタマーは多くの潜在的な標的のために生成することができます。 SELEX中にRNAアプタマーをターゲットに直接導入することにより、非常に選択的で高親和性の均一なRNAアプタマーのプールを生成できます。そのため、RNAアプタマーは、小さなペプチドやタンパク質だけでなく、細胞断片、細胞全体、さらには特定の組織を標的にするように作成することができます[6][77][96][97][89][98]。RNAアプタマーの分子標的および潜在的な標的の例には、血管内皮増殖因子[99]、骨芽細胞[100]、およびC-X-Cケモカインリガンド12(CXCL2)が含まれます[6][7][101]。

RNAアプタマー療法の例には、FDAが承認した唯一のRNAアプタマー治療であるペガプタニブ(別名Macugen®)が含まれます[6][7][77]。加齢性黄斑変性症の治療のために2004年に最初に承認されたペガプタニブは、VEGFアンタゴニストとして作用する28ヌクレオチドのRNAアプタマーです[6][7][77]。ただし、ベバシズマブやラニビズマブなどの抗体ベースの治療ほど効果的ではありません[77][102][103]。RNAアプタマー治療の別の例は、慢性リンパ性白血病、膵臓癌、および他の癌の臨床試験にある45ヌクレオチドのRNAアプタマーであるNOX-A12です[7]。NOX-A12は、腫瘍増殖に関与するケモカインであるCXCL12 / SDF-1のアンタゴニストとして作用します[7]。
制限事項
RNAアプタマーの高い選択性と緊密な結合により、医薬品としての使用に関心が集まっていますが、invivoでの成功を妨げる多くの問題があります。一つには、変更なしで、RNAアプタマーは数分のスパンでヌクレアーゼによって体内に導入された後に分解されます[7][77][104][105]。また、サイズが小さいため、RNAアプタマーは腎臓系によって血流から除去されます[7][77][78][104][105]。RNAアプタマーは負電荷を帯びているため、血流中のタンパク質に結合し、非標的組織への送達と毒性を引き起こすことがさらに知られています[77][106][107]。繰り返されるシトシン-リン酸-グアニン(CpG)配列を含むアプタマーは、Toll様受容体経路を介して免疫系の活性化を引き起こすため、RNAアプタマーを単離する際にも注意が必要です[7][108][109] 。
RNAアプタマーのインビボ制限のいくつかと戦うために、アプタマーの有効性を助けるために様々な修飾をヌクレオチドに加えることができる。例えば、ポリエチレングリコール(PEG)部分を付着させてアプタマーのサイズを大きくし、それによって腎糸球体による血流からのアプタマーの除去を防ぐことができます[110][111]。しかし、PEGはinvivo試験中のアレルギー反応に関係しているとされています[77][112][113]。さらに、2 'フルオロ基またはアミノ基や3'逆チミジンなどのヌクレアーゼ分解を防ぐための修飾を加えることができます[7][77][114][115]。さらに、リボース糖がD型ではなくL型になるようにアプタマーを合成して、ヌクレアーゼ認識をさらに防ぐことができます[6][77][116][117]。そのようなアプタマーはSpiegelmersとして知られています[6][117]。Toll様受容体経路の活性化を防ぐために、アプタマー内のシトシン核酸塩基をメチル化することができます[7]。それにもかかわらず、インビボでの効力を低下させるこれらの潜在的な解決策にもかかわらず、アプタマーを化学的に修飾すると、その標的に対するその結合親和力が弱まる可能性がある[77][118]。
参照
脚注
- ^ “The 'anti-hype' vaccine”. Nature Biotechnology 35 (3): 193–197. (March 2017). doi:10.1038/nbt.3812. PMID 28244993.
- ^ “Our COVID-19 Vaccine Study – What's Next? | Pfizer”. www.pfizer.com. 2020年11月29日閲覧。
- ^ a b “siRNA-mediated heterochromatin establishment requires HP1 and is associated with antisense transcription”. Molecular Cell 31 (2): 178–89. (July 2008). doi:10.1016/j.molcel.2008.07.003. PMC 2575423. PMID 18657501.
- ^ a b c d e f g h i j “Journey of siRNA: Clinical Developments and Targeted Delivery”. Nucleic Acid Therapeutics 28 (4): 209–224. (August 2018). doi:10.1089/nat.2017.0715. PMID 29584585.
- ^ a b c d e f g “MicroRNAs: target recognition and regulatory functions”. Cell 136 (2): 215–33. (January 2009). doi:10.1016/j.cell.2009.01.002. PMC 3794896. PMID 19167326.
- ^ a b c d e f g h i j k l m n o p q r “Aptamer-based targeted therapy”. Advanced Drug Delivery Reviews 134: 65–78. (September 2018). doi:10.1016/j.addr.2018.08.005. PMC 6239901. PMID 30125604.
- ^ a b c d e f g h i j k l m n o p “Aptamers in the Therapeutics and Diagnostics Pipelines”. Theranostics 8 (15): 4016–4032. (2018-07-01). doi:10.7150/thno.25958. PMC 6096388. PMID 30128033.
- ^ a b “Analysis of aptamer discovery and technology” (英語). Nature Reviews Chemistry 1 (10): 1–16. (2017-10-04). doi:10.1038/s41570-017-0076. ISSN 2397-3358.
- ^ (英語) The mRNA Metabolism in Human Disease. 1157. Cham: Springer International Publishing. (2019). 133–177. doi:10.1007/978-3-030-19966-1_7. ISBN 978-3-030-19965-4. PMID 31342441
- ^ “Messenger RNA (mRNA)”. Genome.gov. 2020年10月5日閲覧。
- ^ “mRNA” (英語). Biology Dictionary (2016年11月25日). 2020年11月30日閲覧。
- ^ “Chapter 2 - Control of Hormone Gene Expression”. Endocrinology: Adult and Pediatric (Seventh ed.). Philadelphia: W.B. Saunders. (January 2016). pp. 16–29.e2. doi:10.1016/B978-0-323-18907-1.00002-0. ISBN 978-0-323-18907-1
- ^ “Current prospects for mRNA gene delivery”. European Journal of Pharmaceutics and Biopharmaceutics 71 (3): 484–9. (March 2009). doi:10.1016/j.ejpb.2008.09.016. PMID 18948192.
- ^ “Advances in Development of mRNA-Based Therapeutics”. Current Topics in Microbiology and Immunology (Berlin, Heidelberg: Springer): 1–20. (July 2020). doi:10.1007/82_2020_222. PMID 32683507.
- ^ “Nucleic acid economy in bacteria infected with bacteriophage T2”. The Journal of General Physiology 37 (1): 1–23. (September 1953). doi:10.1085/jgp.37.1.1. PMC 2147426. PMID 13084888.
- ^ “Phosphorus incorporation in Escherichia coli ribonucleic acid after infection with bacteriophage T2”. Virology 2 (2): 149–161. (April 1956). doi:10.1016/0042-6822(56)90016-2. PMID 13312220.
- ^ “An unstable intermediate carrying information from genes to ribosomes for protein synthesis”. Nature 190 (4776): 576–581. (May 1961). Bibcode: 1961Natur.190..576B. doi:10.1038/190576a0. PMID 20446365.
- ^ “Unstable ribonucleic acid revealed by pulse labelling of Escherichia coli”. Nature 190 (4776): 581–5. (May 1961). Bibcode: 1961Natur.190..581G. doi:10.1038/190581a0. PMID 13708983.
- ^ “Direct gene transfer into mouse muscle in vivo”. Science 247 (4949 Pt 1): 1465–8. (March 1990). Bibcode: 1990Sci...247.1465W. doi:10.1126/science.1690918. PMID 1690918.
- ^ a b “mRNA-based therapeutics--developing a new class of drugs”. Nature Reviews. Drug Discovery 13 (10): 759–80. (October 2014). doi:10.1038/nrd4278. PMID 25233993.
- ^ “In vitro-Transcribed mRNA Therapeutics: Out of the Shadows and Into the Spotlight”. Molecular Therapy 27 (4): 691–692. (April 2019). doi:10.1016/j.ymthe.2019.03.009. PMC 6453554. PMID 30905578.
- ^ “In vitro-synthesized infectious RNA as an attenuated live vaccine in a flavivirus model”. Nature Medicine 4 (12): 1438–40. (December 1998). doi:10.1038/4031. PMID 9846585.
- ^ “In vivo application of RNA leads to induction of specific cytotoxic T lymphocytes and antibodies”. European Journal of Immunology 30 (1): 1–7. (January 2000). doi:10.1002/1521-4141(200001)30:1<1::aid-immu1>3.0.co;2-#. PMID 10602021.
- ^ “How mRNA therapeutics are entering the monoclonal antibody field”. Journal of Translational Medicine 17 (1): 54. (February 2019). doi:10.1186/s12967-019-1804-8. PMC 6387507. PMID 30795778.
- ^ a b c “Advances in mRNA Vaccines for Infectious Diseases” (英語). Frontiers in Immunology 10: 594. (2019). doi:10.3389/fimmu.2019.00594. PMC 6446947. PMID 30972078.
- ^ “TLR signaling in B-cell development and activation”. Cellular & Molecular Immunology 10 (2): 103–6. (March 2013). doi:10.1038/cmi.2012.61. PMC 4003046. PMID 23241902.
- ^ “RIG-I-Like Receptors and Type I Interferonopathies”. Journal of Interferon & Cytokine Research 37 (5): 207–213. (May 2017). doi:10.1089/jir.2016.0095. PMC 5439449. PMID 28475461.
- ^ “Characterization of a messenger RNA polynucleotide vaccine vector”. Cancer Research 55 (7): 1397–400. (April 1995). PMID 7882341.
- ^ “Characterization of a messenger RNA polynucleotide vaccine vector”. Cancer Research 55 (7): 1397–400. (April 1995). PMID 7882341.
- ^ “Induction of cytotoxic T cell responses and tumor immunity against unrelated tumors using telomerase reverse transcriptase RNA transfected dendritic cells”. Nature Medicine 6 (9): 1011–7. (September 2000). doi:10.1038/79519. PMID 10973321.
- ^ Argos Therapeutics (2018-06-13). An International Phase 3 Randomized Trial of Autologous Dendritic Cell Immunotherapy (AGS-003) Plus Standard Treatment of Advanced Renal Cell Carcinoma (ADAPT).
- ^ “Simultaneous ex vivo quantification of antigen-specific CD4+ and CD8+ T cell responses using in vitro transcribed RNA”. Cancer Immunology, Immunotherapy 56 (10): 1577–87. (October 2007). doi:10.1007/s00262-007-0302-7. PMID 17361438.
- ^ “Increased antigen presentation efficiency by coupling antigens to MHC class I trafficking signals”. Journal of Immunology 180 (1): 309–18. (January 2008). doi:10.4049/jimmunol.180.1.309. PMID 18097032.
- ^ “Phosphorothioate cap analogs increase stability and translational efficiency of RNA vaccines in immature dendritic cells and induce superior immune responses in vivo”. Gene Therapy 17 (8): 961–71. (August 2010). doi:10.1038/gt.2010.52. PMID 20410931.
- ^ BioNTech RNA Pharmaceuticals GmbH (2020-01-14). Clinical First-in-human Dose Escalation Study Evaluating the Safety and Tolerability of Intranodal Administration of an RNA-based Cancer Vaccine Targeting Two Tumor-associated Antigens in Patients With Advanced Melanoma.
- ^ “Self-Delivering RNAi Targeting PD-1 Improves Tumor-Specific T Cell Functionality for Adoptive Cell Therapy of Malignant Melanoma”. Molecular Therapy 26 (6): 1482–1493. (June 2018). doi:10.1016/j.ymthe.2018.04.015. PMC 5986970. PMID 29735366.
- ^ “Simultaneous blocking of CD47 and PD-L1 increases innate and adaptive cancer immune responses and cytokine release”. EBioMedicine 42: 281–295. (April 2019). doi:10.1016/j.ebiom.2019.03.018. PMC 6491392. PMID 30878596.
- ^ “mRNA-4157 | Moderna, Inc.”. www.modernatx.com. 2020年11月30日閲覧。
- ^ “Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA”. European Journal of Immunology 23 (7): 1719–22. (July 1993). doi:10.1002/eji.1830230749. PMID 8325342.
- ^ “Rapidly produced SAM(®) vaccine against H7N9 influenza is immunogenic in mice”. Emerging Microbes & Infections 2 (8): e52. (August 2013). doi:10.1038/emi.2013.54. PMC 3821287. PMID 26038486.
- ^ “Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection”. Nature Biotechnology 30 (12): 1210–6. (December 2012). doi:10.1038/nbt.2436. PMID 23159882.
- ^ “Immunologic activity and safety of autologous HIV RNA-electroporated dendritic cells in HIV-1 infected patients receiving antiretroviral therapy”. Clinical Immunology 134 (2): 140–7. (February 2010). doi:10.1016/j.clim.2009.09.009. PMC 2818410. PMID 19889582.
- ^ “mRNA-based dendritic cell vaccination induces potent antiviral T-cell responses in HIV-1-infected patients”. Aids 26 (4): F1-12. (February 2012). doi:10.1097/qad.0b013e32834f33e8. PMID 22156965.
- ^ “The COVID-19 Pandemic: A Comprehensive Review of Taxonomy, Genetics, Epidemiology, Diagnosis, Treatment, and Control”. Journal of Clinical Medicine 9 (4): 1225. (April 2020). doi:10.3390/jcm9041225. PMC 7230578. PMID 32344679.
- ^ “Drug”. Default. 2020年11月30日閲覧。
- ^ “An mRNA Vaccine against SARS-CoV-2 - Preliminary Report”. The New England Journal of Medicine 383 (20): 1920–1931. (November 2020). doi:10.1056/NEJMoa2022483. PMC 7377258. PMID 32663912.
- ^ “Moderna's Work on a COVID-19 Vaccine Candidate | Moderna, Inc.”. www.modernatx.com. 2020年11月30日閲覧。
- ^ a b “The many pathways of RNA degradation”. Cell 136 (4): 763–76. (February 2009). doi:10.1016/j.cell.2009.01.019. PMID 19239894.
- ^ “Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery”. Molecular Therapy 27 (4): 710–728. (April 2019). doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
- ^ “Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells”. DNA Research 16 (1): 45–58. (February 2009). doi:10.1093/dnares/dsn030. PMC 2644350. PMID 19001483.
- ^ “Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells”. DNA Research 16 (1): 45–58. (February 2009). doi:10.1093/dnares/dsn030. PMC 2644350. PMID 19001483.
- ^ “Nucleic acid vaccines: prospects for non-viral delivery of mRNA vaccines”. Expert Opinion on Drug Delivery 11 (6): 885–99. (June 2014). doi:10.1517/17425247.2014.901308. PMID 24665982.
- ^ “Intradermal Delivery of Synthetic mRNA Using Hollow Microneedles for Efficient and Rapid Production of Exogenous Proteins in Skin”. Molecular Therapy. Nucleic Acids 11: 382–392. (June 2018). doi:10.1016/j.omtn.2018.03.005. PMC 5992458. PMID 29858073.
- ^ “7.19A: RNA Regulation and Antisense RNA” (英語). Biology LibreTexts (2017年6月6日). 2020年12月1日閲覧。
- ^ “Highly sensitive target-based whole-cell antibacterial discovery strategy by antisense RNA silencing”. Current Opinion in Drug Discovery & Development 10 (2): 160–6. (March 2007). PMID 17436551.
- ^ US 2017283805, Bonci D, De Maria R, "Antisense RNA for Treating Cancer and Inhibition of Metastasis and Vectors for Antisense Sequestration", published 2017, assigned to Istituto Superiore di Sanità
- ^ “Antisense RNA”. Brenner's Encyclopedia of Genetics. (2013). doi:10.1016/B978-0-12-809633-8.06068-4. ISBN 978-0-12-809633-8
- ^ “Antisense RNA: the new favorite in genetic research”. Journal of Zhejiang University. Science. B 19 (10): 739–749. (2018). doi:10.1631/jzus.B1700594. PMC 6194357. PMID 30269442.
- ^ “Antisense Therapy: An Overview” (英語). Antisense Therapy. (2019-11-20). doi:10.5772/intechopen.86867. ISBN 978-1-78984-532-7.
- ^ “Antisense therapeutics in oncology: current status”. OncoTargets and Therapy 7: 2035–42. (November 2014). doi:10.2147/ott.s49652. PMC 4224095. PMID 25395862.
- ^ “Antisense Oligonucleotide-based Therapeutics”, Gene Therapy (CRC Press): pp. 365–392, (May 2000), ISBN 978-0-429-13193-6
- ^ Annual Review of Pharmacology and Toxicology 0. (2007-01-10). doi:10.1146/pharmtox.2009.49.issue-1.
- ^ a b c d e f g h “The Potential for microRNA Therapeutics and Clinical Research” (英語). Frontiers in Genetics 10: 478. (2019). doi:10.3389/fgene.2019.00478. PMC 6532434. PMID 31156715.
- ^ a b c d e f g h i j k l “siRNA-based approaches in cancer therapy”. Cancer Gene Therapy 13 (9): 819–29. (September 2006). doi:10.1038/sj.cgt.7700931. PMID 16424918.
- ^ “Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans”. The Plant Cell 2 (4): 279–289. (April 1990). doi:10.1105/tpc.2.4.279. PMC 159885. PMID 12354959.
- ^ “RNA interference”. Nature 418 (6894): 244–51. (July 2002). Bibcode: 2002Natur.418..244H. doi:10.1038/418244a. PMID 12110901.
- ^ a b c “Perspective: machines for RNAi”. Genes & Development 19 (5): 517–29. (March 2005). doi:10.1101/gad.1284105. PMID 15741316.
- ^ a b c “The ins and outs of RNAi in mammalian cells”. Current Pharmaceutical Biotechnology 5 (5): 441–50. (October 2004). doi:10.2174/1389201043376643. PMID 15544492.
- ^ “Sustained small interfering RNA-mediated human immunodeficiency virus type 1 inhibition in primary macrophages”. Journal of Virology 77 (13): 7174–81. (July 2003). doi:10.1128/JVI.77.13.7174-7181.2003. PMC 164789. PMID 12805416.
- ^ “RNA interference targeting Fas protects mice from fulminant hepatitis”. Nature Medicine 9 (3): 347–51. (March 2003). doi:10.1038/nm828. PMID 12579197.
- ^ “Micro RNAs are complementary to 3' UTR sequence motifs that mediate negative post-transcriptional regulation”. Nature Genetics 30 (4): 363–4. (April 2002). doi:10.1038/ng865. PMID 11896390.
- ^ “Expression profiling reveals off-target gene regulation by RNAi”. Nature Biotechnology 21 (6): 635–7. (June 2003). doi:10.1038/nbt831. PMID 12754523.
- ^ a b c d e “The promise of microRNA replacement therapy”. Cancer Research 70 (18): 7027–30. (September 2010). doi:10.1158/0008-5472.CAN-10-2010. PMC 2940943. PMID 20807816.
- ^ a b “Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34”. Cancer Research 70 (14): 5923–30. (July 2010). doi:10.1158/0008-5472.CAN-10-0655. PMC 2913706. PMID 20570894.
- ^ “Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model”. Cell 137 (6): 1005–17. (June 2009). doi:10.1016/j.cell.2009.04.021. PMC 2722880. PMID 19524505.
- ^ a b “A G-quadruplex-containing RNA activates fluorescence in a GFP-like fluorophore”. Nature Chemical Biology 10 (8): 686–91. (August 2014). doi:10.1038/nchembio.1561. PMC 4104137. PMID 24952597.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac “Aptamers as targeted therapeutics: current potential and challenges”. Nature Reviews. Drug Discovery 16 (3): 181–202. (March 2017). doi:10.1038/nrd.2016.199. PMC 5700751. PMID 27807347.
- ^ a b “The emerging field of RNA nanotechnology”. Nature Nanotechnology 5 (12): 833–42. (December 2010). Bibcode: 2010NatNa...5..833G. doi:10.1038/nnano.2010.231. PMC 3149862. PMID 21102465.
- ^ “Embracing proteins: structural themes in aptamer-protein complexes”. Current Opinion in Structural Biology 36: 122–32. (February 2016). doi:10.1016/j.sbi.2016.01.009. PMID 26919170.
- ^ “RNA aptamers that bind L-arginine with sub-micromolar dissociation constants and high enantioselectivity”. Nucleic Acids Research 24 (6): 1029–36. (March 1996). doi:10.1093/nar/24.6.1029. PMC 145747. PMID 8604334.
- ^ “The isolation of an RNA aptamer targeting to p53 protein with single amino acid mutation”. Proceedings of the National Academy of Sciences of the United States of America 112 (32): 10002–7. (August 2015). Bibcode: 2015PNAS..11210002C. doi:10.1073/pnas.1502159112. PMC 4538674. PMID 26216949.
- ^ “Aptamers as therapeutics”. Nature Reviews. Drug Discovery 9 (7): 537–50. (July 2010). doi:10.1038/nrd3141. PMC 7097324. PMID 20592747.
- ^ “Stable RNA nanoparticles as potential new generation drugs for cancer therapy”. Advanced Drug Delivery Reviews 66: 74–89. (February 2014). doi:10.1016/j.addr.2013.11.006. PMC 3955949. PMID 24270010.
- ^ a b “Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase”. Science 249 (4968): 505–10. (August 1990). Bibcode: 1990Sci...249..505T. doi:10.1126/science.2200121. PMID 2200121.
- ^ a b c “In vitro selection of RNA molecules that bind specific ligands”. Nature 346 (6287): 818–22. (August 1990). Bibcode: 1990Natur.346..818E. doi:10.1038/346818a0. PMID 1697402.
- ^ “CELL-SELEX: Novel perspectives of aptamer-based therapeutics”. International Journal of Molecular Sciences 9 (4): 668–78. (April 2008). doi:10.3390/ijms9040668. PMC 2635693. PMID 19325777.
- ^ “Cell-SELEX Technology”. BioResearch Open Access 1 (6): 265–272. (2012). doi:10.1089/biores.2012.0253. PMC 3559206. PMID 23515081.
- ^ “Cell-specific aptamers for targeted therapies”. Nucleic Acid and Peptide Aptamers. Methods in Molecular Biology. 535. Totowa, NJ: Humana Press. (2009). pp. 59–78. doi:10.1007/978-1-59745-557-2_5. ISBN 978-1-59745-557-2. PMC 4443708. PMID 19377980
- ^ a b “Selection of aptamers for molecular recognition and characterization of cancer cells”. Analytical Chemistry 79 (13): 4900–7. (July 2007). doi:10.1021/ac070189y. PMID 17530817.
- ^ “Cell-specific internalization study of an aptamer from whole cell selection”. Chemistry 14 (6): 1769–75. (2008-02-18). doi:10.1002/chem.200701330. PMID 18092308.
- ^ “Applications of aptamers in cancer cell biology”. Analytica Chimica Acta 621 (2): 101–8. (July 2008). doi:10.1016/j.aca.2008.05.031. PMID 18573375.
- ^ a b c “A clinical trial of retroviral-mediated transfer of a rev-responsive element decoy gene into CD34(+) cells from the bone marrow of human immunodeficiency virus-1-infected children”. Blood 94 (1): 368–71. (July 1999). doi:10.1182/blood.V94.1.368.413a47_368_371. PMID 10381536.
- ^ “Cancer immunotherapy via nucleic acid aptamers”. International Immunopharmacology 29 (2): 926–936. (December 2015). doi:10.1016/j.intimp.2015.10.013. PMID 26603636.
- ^ “Activatable aptamer probe for contrast-enhanced in vivo cancer imaging based on cell membrane protein-triggered conformation alteration”. Proceedings of the National Academy of Sciences of the United States of America 108 (10): 3900–5. (March 2011). Bibcode: 2011PNAS..108.3900S. doi:10.1073/pnas.1016197108. PMC 3054025. PMID 21368158.
- ^ “DNA Aptamer-Based Activatable Probes for Photoacoustic Imaging in Living Mice”. Journal of the American Chemical Society 139 (48): 17225–17228. (December 2017). doi:10.1021/jacs.7b07913. PMC 5724028. PMID 29028325.
- ^ “In vivo selection of tumor-targeting RNA motifs”. Nature Chemical Biology 6 (1): 22–4. (January 2010). doi:10.1038/nchembio.277. PMC 2795795. PMID 19946274.
- ^ “Aptamers evolved from live cells as effective molecular probes for cancer study”. Proceedings of the National Academy of Sciences of the United States of America 103 (32): 11838–43. (August 2006). doi:10.1073/pnas.0602615103. PMC 1567664. PMID 16873550.
- ^ “Molecular recognition of small-cell lung cancer cells using aptamers”. ChemMedChem 3 (6): 991–1001. (June 2008). doi:10.1002/cmdc.200800030. PMC 3544301. PMID 18338423.
- ^ “Pegaptanib for neovascular age-related macular degeneration”. The New England Journal of Medicine 351 (27): 2805–16. (December 2004). doi:10.1056/NEJMoa042760. PMID 15625332.
- ^ “Aptamer-functionalized lipid nanoparticles targeting osteoblasts as a novel RNA interference-based bone anabolic strategy”. Nature Medicine 21 (3): 288–94. (March 2015). doi:10.1038/nm.3791. PMC 5508976. PMID 25665179.
- ^ “The Spiegelmer NOX-A12, a novel CXCL12 inhibitor, interferes with chronic lymphocytic leukemia cell motility and causes chemosensitization”. Blood 123 (7): 1032–9. (February 2014). doi:10.1182/blood-2013-03-493924. PMC 4123413. PMID 24277076.
- ^ “Current status of vascular endothelial growth factor inhibition in age-related macular degeneration”. BioDrugs 24 (3): 183–94. (June 2010). doi:10.2165/11318550-000000000-00000. PMID 20210371.
- ^ “Ten years of anti-vascular endothelial growth factor therapy”. Nature Reviews. Drug Discovery 15 (6): 385–403. (June 2016). doi:10.1038/nrd.2015.17. PMID 26775688.
- ^ a b “Pharmacokinetics and biodistribution of novel aptamer compositions”. Pharmaceutical Research 21 (12): 2234–46. (December 2004). doi:10.1007/s11095-004-7676-4. PMID 15648255.
- ^ a b “Evoking picomolar binding in RNA by a single phosphorodithioate linkage”. Nucleic Acids Research 44 (17): 8052–64. (September 2016). doi:10.1093/nar/gkw725. PMC 5041495. PMID 27566147.
- ^ “Activation of the alternative pathway of complement by a phosphorothioate oligonucleotide: potential mechanism of action”. The Journal of Pharmacology and Experimental Therapeutics 281 (2): 810–6. (May 1997). PMID 9152389.
- ^ “Oligodeoxynucleotide studies in primates: antisense and immune stimulatory indications”. Toxicologic Pathology 31 Suppl: 119–22. (2016-11-17). doi:10.1080/01926230390174995. PMID 12597439.
- ^ “Potential capacity of aptamers to trigger immune activation in human blood”. PLOS ONE 8 (7): e68810. (2013-07-23). Bibcode: 2013PLoSO...868810A. doi:10.1371/journal.pone.0068810. PMC 3720859. PMID 23935890.
- ^ “Innate immune responses induced by CpG oligodeoxyribonucleotide stimulation of ovine blood mononuclear cells”. Immunology 110 (2): 250–7. (October 2003). doi:10.1046/j.1365-2567.2003.01722.x. PMC 1783041. PMID 14511239.
- ^ “Polyvalent nucleic acid aptamers and modulation of their activity: a focus on the thrombin binding aptamer”. Pharmacology & Therapeutics 136 (2): 202–15. (November 2012). doi:10.1016/j.pharmthera.2012.07.011. PMID 22850531.
- ^ “Targeting Two Coagulation Cascade Proteases with a Bivalent Aptamer Yields a Potent and Antidote-Controllable Anticoagulant”. Nucleic Acid Therapeutics 26 (1): 1–9. (February 2016). doi:10.1089/nat.2015.0565. PMC 4753633. PMID 26584417.
- ^ “Pre-existing anti-polyethylene glycol antibody linked to first-exposure allergic reactions to pegnivacogin, a PEGylated RNA aptamer”. The Journal of Allergy and Clinical Immunology 137 (5): 1610–1613.e7. (May 2016). doi:10.1016/j.jaci.2015.10.034. PMC 5819876. PMID 26688515.
- ^ “Effect of the REG1 anticoagulation system versus bivalirudin on outcomes after percutaneous coronary intervention (REGULATE-PCI): a randomised clinical trial”. Lancet 387 (10016): 349–356. (January 2016). doi:10.1016/s0140-6736(15)00515-2. PMID 26547100.
- ^ “ABCs of DNA aptamer and related assay development”. Biotechnology Advances 35 (2): 275–301. (2017-03-01). doi:10.1016/j.biotechadv.2017.01.003. PMID 28108354.
- ^ “Kinetic characterization of ribonuclease-resistant 2'-modified hammerhead ribozymes”. Science 253 (5017): 314–7. (July 1991). Bibcode: 1991Sci...253..314P. doi:10.1126/science.1857967. PMID 1857967.
- ^ “Toward third-generation aptamers: Spiegelmers and their therapeutic prospects”. Current Opinion in Drug Discovery & Development 6 (2): 253–61. (March 2003). PMID 12669461.
- ^ a b “Antidote-mediated control of an anticoagulant aptamer in vivo”. Nature Biotechnology 22 (11): 1423–8. (November 2004). doi:10.1038/nbt1023. PMID 15502817.
- ^ “Smart functional nucleic acid chimeras: enabling tissue specific RNA targeting therapy”. RNA Biology 12 (4): 412–25. (2015-04-03). doi:10.1080/15476286.2015.1017234. PMC 4615226. PMID 25849197.
関連項目
- RNA therapeutics on the rise, Nature (April 2020}
