「プロテアーゼ」の版間の差分
m 211.1.214.140 (会話) による版を にょろん による版へ巻き戻し タグ: 巻き戻し |
Baudanbau20 (会話 | 投稿記録) m →酵素の機能・機構: リンク先とリンク文が同一 |
||
| (2人の利用者による、間の2版が非表示) | |||
| 1行目: | 1行目: | ||
[[File:TEV protease summary.png|thumb|250px| |
{{short description|他のタンパク質をより小さなペプチドに切断する酵素}} |
||
[[File:TEV protease summary.png|thumb|250px|[[TEVプロテアーゼ]]の構造。[[基質 (化学)|基質]]とのペプチド結合を黒、触媒[[残基]]を赤で表す。({{PDB|1LVB}})]] |
|||
'''プロテアーゼ''' (protease)は、[[タンパク質]]をより小さな[[ポリペプチド]]や単一の[[アミノ酸]]への[[タンパク質分解|分解]]を[[触媒]]する (速度を上げる) [[加水分解酵素]]の総称である。'''ペプチダーゼ''' (peptidase) や'''プロテイナーゼ'''(proteinase)とも呼ばれる。それらは、水が反応して結合を壊す[[加水分解]]によってタンパク質内のペプチド結合を切断する。プロテアーゼは、摂取したタンパク質の消化、タンパク質の[[異化 (生物学)|異化]]作用 (古いタンパク質の分解)、[[細胞シグナル伝達]]など、多くの生物学的機能に関与している<ref name="King 996–1007">{{Cite journal|last=King|first=John V.|last2=Liang|first2=Wenguang G.|last3=Scherpelz|first3=Kathryn P.|last4=Schilling|first4=Alexander B.|last5=Meredith|first5=Stephen C.|last6=Tang|first6=Wei-Jen|date=2014-07-08|title=Molecular basis of substrate recognition and degradation by human presequence protease|journal=Structure|volume=22|issue=7|pages=996–1007|doi=10.1016/j.str.2014.05.003|issn=1878-4186|pmc=4128088|pmid=24931469}}</ref><ref name="Shen 870–874">{{Cite journal|last=Shen|first=Yuequan|last2=Joachimiak|first2=Andrzej|last3=Rosner|first3=Marsha Rich|last4=Tang|first4=Wei-Jen|date=2006-10-19|title=Structures of human insulin-degrading enzyme reveal a new substrate recognition mechanism|journal=Nature|volume=443|issue=7113|pages=870–874|doi=10.1038/nature05143|issn=1476-4687|pmc=3366509|pmid=17051221}}</ref>。 |
|||
'''プロテアーゼ'''(Protease、[[EC番号|EC]] 3.4群)とは[[ペプチド結合]][[加水分解酵素]]の総称で、プロテイナーゼ(proteinase)とも呼ばれる。広義のペプチダーゼ(Peptidase)のこと。[[タンパク質]]やポリ[[ペプチド]]の[[タンパク質分解|加水分解]]酵素で、それらを加水分解して[[異化 (生物学)|異化]]する。[[収斂進化]]により、全く異なる[[触媒]]機能を持つプロテアーゼが似たような働きを持つ。プロテアーゼは動物、植物、[[バクテリア]]、[[古細菌]]、[[ウイルス]]などにある。ヒトでは[[小腸]]上皮[[細胞]]から分泌する。 |
|||
プロテアーゼのような付加的な助力機構がない場合、タンパク質分解は非常に遅く、何百年もかかる反応である<ref>{{cite journal | vauthors = Radzicka A, Wolfenden R | title = Rates of Uncatalyzed Peptide Bond Hydrolysis in Neutral Solution and the Transition State Affinities of Proteases | journal = JACS | volume = 118 | issue = 26 | pages = 6105–6109 | date = July 1996 | doi = 10.1021/ja954077c }}</ref>。プロテアーゼは、植物、動物、バクテリア、古細菌などあらゆる形態の生命体や[[ウイルス]]に見られる。それらは独立して[[収斂進化]] (しゅうれんしんか) しており、異なるクラスのプロテアーゼは、完全に異なる[[酵素反応|触媒機構]]によって同じ反応を実行できる。 |
|||
== 機能 == |
|||
[[アミノ酸]]が[[ペプチド結合]]によって鎖状に連結した[[ペプチド]](一般に100[[残基]]未満、比較的[[分子量]]が小さい)や[[タンパク質]](一般に100残基以上、比較的[[分子量]]が大きい)のペプチド結合を加水分解する酵素で、様々な種類のものが、生理的役割として、栄養吸収、タンパク質の廃棄とリサイクル、生体防御、活性の調節、などの幅広い分野で働いている。 |
|||
== プロテアーゼの分類<!-- Hierarchy of proteases -->== |
|||
== 分類 == |
|||
プロテアーゼの分類は歴史的に様々な変遷を経ている。今日では切断位置による'''エキソペプチダーゼ'''ないしは'''エンドペプチダーゼ'''の分類が広く用いられる<ref name="岩波生物学辞典">「プロテアーゼ」、『岩波生物学辞典』第4版、岩波書店、1996年。</ref>。 |
|||
=== 触媒残基に基づく分類<!-- Based on catalytic residue -->=== |
|||
* 分解の位置による分類 |
|||
プロテアーゼは大きく分けて7つのグループに分類される<ref>{{cite journal |title=New families of carboxyl peptidases: serine-carboxyl peptidases and glutamic peptidases | first = Kohei | last = Oda | name-list-style = vanc |journal=Journal of Biochemistry |year=2012 |volume=151|issue=1|pages=13–25| doi= 10.1093/jb/mvr129 |pmid= 22016395 |doi-access=free }}</ref>。 |
|||
** '''エキソペプチダーゼ'''– [[タンパク質]]・[[ペプチド]]鎖の配列末端から(およそ1〜2[[アミノ酸]][[残基]]ずつ)切り取るタイプのもの。 |
|||
** '''エンドペプチダーゼ'''– タンパク質・ペプチド鎖の配列中央を切断するタイプのもの。 |
|||
* 基質による分類 |
|||
** [[プロテイナーゼ]](Proteinase)– タンパク質を分解するもの。 |
|||
** (狭義の)ペプチダーゼ(Peptidase)– より分子量の小さな合成[[ペプチド]]などを分解するもの<ref name="岩波生物学辞典" />。 |
|||
* 触媒機構による分類 |
|||
** [[セリンプロテアーゼ]]– [[キモトリプシン]](chymotrypsin)、[[スブチリシン]](subtilisin)、[[ナットウキナーゼ]]など。 |
|||
** [[アスパラギン酸プロテアーゼ]](酸性プロテアーゼ)(aspartic protease)– [[ペプシン]]、[[カテプシン]]D(cathepsin D)、[[ヒト免疫不全ウイルス|HIV]]プロテアーゼなど。 |
|||
** [[金属プロテアーゼ]](metallo protease)– [[サーモリシン]](thermolysin)など。 |
|||
** [[システインプロテアーゼ]](cysteine protease)– [[パパイン]]、[[カスパーゼ]]など。 |
|||
** この他にも[[プロテアソ−ム]](proteasome)で知られるようになった[[N-末端スレオニンプロテアーゼ]](N-terminal threonine protease)や[[グルタミン酸プロテアーゼ]](glutamic protease)などが新たに見つかっている。 |
|||
* [[セリンプロテアーゼ]] - セリン[[アルコール]]を使用 |
|||
古くはタンパク質を基質にするものを「プロテイナーゼ」、合成ペプチドを基質にするものを「ペプチダーゼ」としていたが、分類の境界が不明瞭である。現在のエンドペプチダーゼには従来プロテイナーゼに分類されていた大半の酵素が含まれ、エキソペプチダーゼには従来ペプチダーゼに分類されていたものの多くが属する。 |
|||
* [[システインプロテアーゼ]] - システイン[[チオール]]を使用 |
|||
* {{仮リンク|スレオニンプロテアーゼ|en|Threonine protease|label=}} - スレオニン[[アルコール#構造による分類|二級アルコール]]を使用 |
|||
* {{仮リンク|アスパラギン酸プロテアーゼ|en|Aspartic protease|label=}} - アスパラギン酸[[カルボン酸]]を使用 |
|||
* {{仮リンク|グルタミン酸プロテアーゼ|en|Glutamic protease|label=}} - グルタミン酸[[カルボン酸]]を使用 |
|||
* [[メタロプロテアーゼ]] (金属プロテアーゼ) - 金属、通常は[[亜鉛]]を使用<ref name="King 996–1007" /><ref name="Shen 870–874" /> |
|||
* {{仮リンク|アスパラギンペプチドリアーゼ|en|Asparagine peptide lyase|label=}} - アスパラギンを使用して[[脱離反応]]を行う (水を必要としない) |
|||
プロテアーゼは、1993年に進化的関係に基づいて最初に84ファミリーに分類され、セリンプロテアーゼ、システインプロテアーゼ、アスパラギンプロテアーゼ、メタロプロテアーゼの4つの触媒型に分類された<ref>{{cite journal | vauthors = Rawlings ND, Barrett AJ | title = Evolutionary families of peptidases | journal = The Biochemical Journal | volume = 290 ( Pt 1) | issue = Pt 1 | pages = 205–18 | date = February 1993 | pmid = 8439290 | pmc = 1132403 | doi = 10.1042/bj2900205 }}</ref>。[[スレオニン]]プロテアーゼと[[グルタミン酸]]プロテアーゼは、それぞれ1995年と2004年まで記載されていなかった。[[ペプチド結合]]を切断する機構は、[[システイン]]とスレオニンを持つ[[アミノ酸]]残基 (プロテアーゼ) または水分子 (アスパラギン酸、メタロプロテアーゼ、酸プロテアーゼ) がペプチド[[カルボキシル基]]を攻撃できるように[[求核性]]にすることである。求核試薬を作成する一つの方法は、[[ヒスチジン]]残基を用いて[[セリン]]、[[システイン]]、または[[スレオニン]]を求核剤として活性化させる[[触媒三残基]]である。ただし、求核試薬の種類はさまざまな[[タンパク質ファミリー|スーパーファミリー]]で[[収斂進化]]しており、一部のスーパーファミリーは複数の異なる求核試薬への分岐進化を示しているため、これは進化的なグループではない。 |
|||
エキソペプチダーゼのうち、基質のN末端から1残基ずつ切断する酵素を'''アミノペプチダーゼ'''、C末端側から1残基ずつ切断する酵素を'''カルボキシペプチダーゼ'''と呼ぶ。 |
|||
==== ペプチドリアーゼ<!-- Peptide lyases --> ==== |
|||
ペプチダーゼのうち、アルカリ性領域に至適pHを持つものは、洗剤補助剤として日用品に利用されるため、'''アルカリ(性)プロテアーゼ'''とよばれることがある。 |
|||
2011年に、第7の触媒型のタンパク質分解酵素であるアスパラギンペプチドリアーゼが報告された。そのタンパク質分解機構は、[[加水分解]]ではなく、[[脱離反応]]を行う珍しいものである<ref name=":0">{{cite journal | vauthors = Rawlings ND, Barrett AJ, Bateman A | title = Asparagine peptide lyases: a seventh catalytic type of proteolytic enzymes | journal = The Journal of Biological Chemistry | volume = 286 | issue = 44 | pages = 38321–8 | date = November 2011 | pmid = 21832066 | pmc = 3207474 | doi = 10.1074/jbc.M111.260026 }}</ref>。この反応では、触媒アスパラギンは、適切な条件下でタンパク質中のアスパラギン残基でそれ自体を切断する環状の化学構造を形成する。その根本的に異なる機構を考えると、ペプチダーゼに含まれるかどうかは議論の余地があ<ref name=":0" />る。 |
|||
=== 進化的な系統<!-- Evolutionary phylogeny -->=== |
|||
== 基質特異性 == |
|||
プロテアーゼの進化的[[スーパーファミリー]]の最新の分類は、MEROPSデータベースにある<ref name="pmid19892822">{{cite journal |vauthors=Rawlings ND, Barrett AJ, Bateman A |title=MEROPS: the peptidase database |journal=Nucleic Acids Res. |volume=38 |issue=Database issue |pages=D227–33 |date=January 2010 |pmid=19892822 |pmc=2808883 |doi=10.1093/nar/gkp971 }}</ref>。このデータベースでは、プロテアーゼを構造、機構、触媒残基の順序に基づいて、最初に「クラン」(clan、タンパク質のスーパーファミリー) によって分類している (例: {{仮リンク|PAクラン|en|PA clan of proteases|label=}}はPが求核性ファミリーの混合物を示す)。各「クラン」内でプロテアーゼは、配列類似性に基づいて[[タンパク質ファミリー|ファミリー]]に分類される (例: PAクラン内のS1とC3ファミリー)。各ファミリーには、何百もの関連プロテアーゼ (例: S1ファミリー内の[[トリプシン]]、[[エラスターゼ]]、[[トロンビン]]および[[ストレプトグリシンA|ストレプトグリシン]]など) が含まれる場合がある。 |
|||
プロテアーゼには切断する配列をあまり選ばない([[基質特異性]]が低い)ものや、特定のタンパク質・ペプチドの特定の部位だけを特異的に切断するという切断する配列に対する高度な選択性を持つ([[基質特異性]]が高い)タイプのものがある。[[ペプシン]](pepsin)や[[キモトリプシン]](chymotrypsin)などが前者の、ケキシン(Kexin)やフューリン(Furin)のような[[プロセッシング]]プロテアーゼ、[[Xa因子]]のような[[血液凝固因子]]などが後者の例として典型的なものである。前述の[[ヒト免疫不全ウイルス|HIV]]プロテアーゼはその基質特異性故にHIV治療の重要な標的となり、阻害剤による治療が大きな成果を上げている。 |
|||
現在、50以上のクランが知られており、それぞれがタンパク質分解の独立した進化的起源を示している<ref name="pmid19892822" />。 |
|||
=== 最適pHに基づく分類<!-- Classification based on optimal pH --> === |
|||
また、プロテアーゼは、それらが活性を発揮する最適な[[水素イオン指数|pH]]によって分類されることもある。 |
|||
* '''酸性プロテアーゼ''' |
|||
* {{仮リンク|I型過敏症|en|Type I hypersensitivity|label=}}に関与する'''中性プロテアーゼ'''。ここでは、[[肥満細胞]]から放出され、[[補体]]や[[キニン]]の活性化を引き起こす<ref name="Kumar122">{{cite book | last1 = Mitchell | first1 = Richard Sheppard | last2 = Kumar | first2 = Vinay | last3 = Abbas | first3 = Abul K. | last4 = Fausto | first4 = Nelson | name-list-style = vanc |title=Robbins Basic Pathology |publisher=Saunders |location=Philadelphia |year= 2007|pages=122 |isbn=978-1-4160-2973-1 | edition = 8th }}</ref>。このグループには[[カルパイン]]が含まれる。 |
|||
* 塩基性プロテアーゼ (または'''アルカリ性プロテアーゼ''') |
|||
== 酵素の機能・機構<!-- Enzymatic function and mechanism -->== |
|||
[[File:Protease mechanism summary.svg|thumb|upright=2.4|[[タンパク質分解]]に使用される2つの[[加水分解]]のメカニズムの比較。[[酵素]]は黒で、[[基質 (化学)|基質]]タンパク質は赤で、[[水]]は青で示されている。上のパネルは、酵素が[[酸]]を使用して水を[[分極]]し、次に、基質を加水分解する1段階の加水分解を示している。下のパネルは、酵素内の残基が活性化されて[[求核剤]] (Nu) として作用し、基質を攻撃する2段階の加水分解を示している。これにより、酵素が基質のN末端半分に共有結合した中間体が形成される。第2段階では、この中間体を加水分解するために水が活性化され、触媒作用が完了する。他の酵素残基 (図示せず) は、水素を供与および受容し、反応機構に沿った電荷蓄積を静電的に安定化させる。]] |
|||
{{see also|触媒三残基}} |
|||
プロテアーゼは、[[アミノ酸]]残基をつなぐ[[ペプチド結合]]を分割させることで、長いタンパク質鎖をより短い断片に[[消化]]することに関与している。 |
|||
今日では切断位置によるエキソペプチダーゼとエンドペプチダーゼの分類が広く用いられる<ref name="岩波生物学辞典">「プロテアーゼ」、『岩波生物学辞典』第4版、岩波書店、1996年。</ref>。 |
|||
* '''[[エキソペプチダーゼ]]''' - タンパク質鎖から末端アミノ酸を切り離す。基質のN末端から1残基ずつ切断する酵素をアミノペプチダーゼ、C末端側から1残基ずつ切断する酵素をカルボキシペプチダーゼと呼ぶ。 |
|||
* '''[[エンドペプチダーゼ]]''' - タンパク質の内部ペプチド結合を攻撃、切断する。[[トリプシン]]、[[キモトリプシン]]、[[サブチリシン]]、[[ペプシン]]、[[パパイン]]、[[エラスターゼ]]など。 |
|||
=== 触媒作用<!-- Catalysis --> === |
|||
[[助触媒|触媒作用]]{{Enlink|Catalysis|英語版}}は、2つの機構のいずれかによって達成される。 |
|||
* アスパラギン酸、グルタミン酸、およびメタロプロテアーゼは、水分子を活性化し、ペプチド結合に求核攻撃を加えて加水分解する。 |
|||
* セリン、スレオニン、およびシステインプロテアーゼは求核性残基を使用する (通常、[[触媒三残基]])。その残基は、求核的な攻撃を実行してプロテアーゼを基質タンパク質に[[共有結合]]させ、生成物の前半を解放する。次に、この共有結合アシル酵素中間体は、活性化された水によって加水分解され、生成物の後半を解放し、遊離酵素を再生することによって触媒作用を完了する。 |
|||
===基質特異性<!-- Specificity -->=== |
|||
タンパク質分解は、非常に[[:en:Enzyme promiscuity|無差別]]{{Enlink|Enzyme promiscuity|英語版}}な可能性があり、広範囲のタンパク質基質が加水分解される。これは、[[トリプシン]]のような消化酵素の場合で、摂取したタンパク質の配列をより小さなペプチド断片に切断できなければならない。無差別プロテアーゼ<!-- promiscuous proteases -->は通常、基質上の単一のアミノ酸に結合するので、その残基に対してのみ[[基質特異性|特異性]]がある。例えば、トリプシンは、配列 ...K/.... または ...R/.... ('/'=切断部位) に特異的である<ref>{{cite journal | vauthors = Rodriguez J, Gupta N, Smith RD, Pevzner PA | title = Does trypsin cut before proline? | journal = Journal of Proteome Research | volume = 7 | issue = 1 | pages = 300–5 | date = January 2008 | pmid = 18067249 | doi = 10.1021/pr0705035 }}</ref>。 |
|||
逆に、一部のプロテアーゼは非常に特異的であり、特定の配列を持つ基質だけを切断する。血液凝固 ([[トロンビン]]など) およびウイルスポリンタンパク質処理 ([[TEVプロテアーゼ]]など) は、正確な切断イベントを達成するためにこのレベルの特異性を必要とする。これは、指定された残基に結合するいくつかのポケットを備えた長い結合溝<!-- long binding cleft -->またはトンネルを有するプロテアーゼによって達成される。たとえば、TEVプロテアーゼは配列 ...ENLYFQ/S... ('/'=切断部位) に特異的である<ref>{{cite journal | vauthors = Renicke C, Spadaccini R, Taxis C | title = A tobacco etch virus protease with increased substrate tolerance at the P1' position | journal = PLOS One | volume = 8 | issue = 6 | pages = e67915 | date = 2013-06-24 | pmid = 23826349 | pmc = 3691164 | doi = 10.1371/journal.pone.0067915 }}</ref>。 |
|||
=== 破壊と自己分解<!-- Degradation and autolysis -->=== |
|||
プロテアーゼは、それ自体がタンパク質であるため、他のプロテアーゼ分子 (時には同じ種類の分子) によって切断される。これはプロテアーゼ活性の調節方法として機能する。一部のプロテアーゼは、自己分解(autolysis)後に活性が低下するが ([[TEVプロテアーゼ]]など) 、他のプロテアーゼは活性が高くなる ({{仮リンク|トリプシノーゲン|en|Trypsinogen|label=}}など)。 |
|||
== プロテアーゼの生物多様性<!-- Biodiversity of proteases --> == |
|||
プロテアーゼは、[[原核生物]]から[[真核生物]]、[[ウイルス]]に至るまで、あらゆる生物に存在している。これらの酵素は、食物タンパク質の単純な消化から高度に制御されたカスケード (たとえば、[[血液凝固]]カスケード、[[補体系]]、[[アポトーシス]]経路、無脊椎動物のプロフェノールオキシダーゼ活性化カスケード) まで、多くの生化学的反応に関与している。プロテアーゼは、タンパク質のアミノ酸配列に応じて、特定のペプチド結合を切断する ('''限定的なタンパク質分解)''' か、またはペプチドを[[アミノ酸]]に完全に分解する ('''無制限なタンパク質分解''') かのいずれかである。その活性は、破壊的な変化 (タンパク質の機能を破壊するか、またはその主成分に消化する)、機能の活性化、またはシグナル伝達経路のシグナルとなることがある。 |
|||
=== 植物<!-- Plants --> === |
|||
'''植物性[[レンネット]]'''<!-- vegetarian rennet -->と呼ばれるプロテアーゼを含む植物樹液は、ヨーロッパや中東で何百年にもわたってコーシャ[[チーズ]]やハラールチーズの製造に使用されてきた。ウィザニア・コアギュランス (''[[:en:Withania coagulans|Withania coagulans]]'' (英語版)) から採れる植物性レンネットは、インド亜大陸で消化不良や糖尿病の[[アーユルヴェーダ]]治療薬として何千年もの間使用されてきた。また[[パニール]]の原料としても使用される。 |
|||
植物ゲノムは、大部分は未知の機能を持っている何百ものプロテアーゼを符号化している。機能がわかっているものは、主に{{仮リンク|個体発生|en|Ontogeny|label=発生}}調節に関与している<ref>{{cite journal | vauthors = van der Hoorn RA | title = Plant proteases: from phenotypes to molecular mechanisms | journal = Annual Review of Plant Biology | volume = 59 | pages = 191–223 | year = 2008 | pmid = 18257708 | doi = 10.1146/annurev.arplant.59.032607.092835 | url = http://pubman.mpdl.mpg.de/pubman/item/escidoc:1221609/component/escidoc:1221608/vanderhoorn_ann_rev_plant_biol_2008.pdf | hdl = 11858/00-001M-0000-0012-37C7-9 }}</ref>。植物プロテアーゼは[[光合成]]の調節にも関与している<ref>{{cite journal | vauthors = Zelisko A, Jackowski G | title = Senescence-dependent degradation of Lhcb3 is mediated by a thylakoid membrane-bound protease | journal = Journal of Plant Physiology | volume = 161 | issue = 10 | pages = 1157–70 | date = October 2004 | pmid = 15535125 | doi = 10.1016/j.jplph.2004.01.006 }}</ref>。 |
|||
== 植物 == |
|||
植物には、プロテアーゼを豊富に含むものがある。 |
植物には、プロテアーゼを豊富に含むものがある。 |
||
* [[パパイヤ]] - 果肉に[[パパイン]]を含む。食肉の改質剤(軟化剤)としての利用も行われている。 |
* [[パパイヤ]] - 果肉に[[パパイン]]を含む。食肉の改質剤(軟化剤)としての利用も行われている。 |
||
* [[パイナップル]] - 果肉に[[ブロメライン|ブロメライン(ブロメリン)]]を含むため、大量に食べると舌に痺れを感じさせる。 |
* [[パイナップル]] - 果肉に[[ブロメライン|ブロメライン(ブロメリン)]]を含むため、大量に食べると舌に痺れを感じさせる。 |
||
| 38行目: | 75行目: | ||
* [[キウイフルーツ]] - 果肉に[[アクチニジン (酵素)|アクチニダイン(アクチニジン)]]を含む。 |
* [[キウイフルーツ]] - 果肉に[[アクチニジン (酵素)|アクチニダイン(アクチニジン)]]を含む。 |
||
== |
===動物<!-- Animals -->=== |
||
プロテアーゼは、さまざまな代謝プロセスのために生物全体で使用されている。胃に分泌される酸性プロテアーゼ ([[ペプシン]]など) や[[十二指腸]]に存在するセリンプロテアーゼ ([[トリプシン]]や[[キモトリプシン]]) によって食物中のタンパク質を消化することができる。血液中の血清中に存在するプロテアーゼ ([[トロンビン]]、[[プラスミン]]、[[ハーゲマン因子]]など) は、血液凝固や血栓の溶解、および免疫系の正しい働きに重要な役割を果たす。その他のプロテアーゼ ([[エラスターゼ]]、カテプシンG) は白血球に存在し、代謝制御においていくつかの異なる役割を果たす。[[ヘビ毒]]の中には、[[マムシ]]の[[出血毒|血毒素]]のようなプロテアーゼもあり、犠牲者の血液凝固カスケードを妨害する。プロテアーゼは、ホルモン、抗体、または他の酵素のような重要な生理学的役割を果たしている他のタンパク質の寿命を決定する。これは、生物の生理学における最も速い「スイッチオン」と「スイッチオフ」の調節機構の一つである。 |
|||
複雑な協調作用により、プロテアーゼは{{仮リンク|生化学カスケード|en|Biochemical cascade|label=カスケード}}反応として進行することがあり、その結果、生理学的シグナルに対する生物の応答の迅速かつ効率的な増幅される。 |
|||
=== バクテリア<!-- Bacteria --> === |
|||
[[バクテリア]] (bacteria、細菌)は、タンパク質のペプチド結合を加水分解するためにプロテアーゼを分泌し、タンパク質を構成[[アミノ酸]]に分解する。タンパク質のリサイクルの中で、地球規模の[[炭素]]と[[窒素]]の循環にとって細菌や真菌のプロテアーゼは特に重要で、そのような活性はこれらの生物の栄養シグナルによって制御される傾向がある<ref>{{cite journal | vauthors = Sims GK | year = 2006 | title = Nitrogen Starvation Promotes Biodegradation of N-Heterocyclic Compounds in Soil | url = https://naldc-legacy.nal.usda.gov/naldc/download.xhtml?id=6863&content=PDF| journal = Soil Biology & Biochemistry | volume = 38 | issue = 8| pages = 2478–2480 | doi=10.1016/j.soilbio.2006.01.006}}</ref>。土壌中に存在する何千もの種の間でプロテアーゼ活性の栄養制御による正味の影響は、タンパク質が炭素、窒素、または硫黄の制限に応じて分解されるように、全体的な微生物群レベルで観察することができる<ref>{{cite journal | vauthors = Sims GK, Wander MM | year = 2002 | title = Proteolytic activity under nitrogen or sulfur limitation | journal = Appl. Soil Ecol. | volume = 568 | pages = 1–5 }}</ref>。 |
|||
細菌には、[[変性|変性タンパク質]] (折りたたまれないまたは過って折りたたまれたタンパク質) を分解することにより、一般的なタンパク質の品質調整<!-- quality control -->に関与するプロテアーゼ (たとえばAAA+[[プロテアソーム]]) が含まれている。 |
|||
分泌された細菌性プロテアーゼはまた、外毒素として作用する可能性があり、細菌性{{仮リンク|病因|en|Pathogenesis|label=}}の[[病原性因子|病原因子]] (たとえば[[黄色ブドウ球菌#病原因子|黄色ブドウ球菌]]の[[外毒素]]) の一例となりうる。細菌性外毒素プロテアーゼは、細胞外構造を破壊する。 |
|||
[[納豆菌]]は、[[フィブリン]] (血栓の主成分) を溶解する[[ナットウキナーゼ]]を含有する。 |
|||
=== ウイルス<!-- Viruses --> === |
|||
一部のウイルスのゲノムは、1つの巨大な[[ポリタンパク質]]<!-- polyprotein -->を符号化しており、これを機能的な単位に切断するためにプロテアーゼが必要である (例えば、[[C型肝炎ウイルス]]や[[ピコルナウイルス科|ピコルナウイルス]])。これらのプロテアーゼ (例えば[[TEVプロテアーゼ]]) は高い特異性を持ち、非常に限られた範囲で基質配列のセットのみを切断する<ref>{{Cite journal|last=Tong|first=Liang | name-list-style = vanc |date=2002|title=Viral Proteases |journal=Chemical Reviews |volume=102|issue=12|pages=4609–4626|doi=10.1021/cr010184f |pmid=12475203 }}</ref>。したがって、これらのプロテアーゼは、[[プロテアーゼ阻害剤 (生物学)|プロテアーゼ阻害剤]]の一般的な標的である<ref>{{cite journal | vauthors = Skoreński M, Sieńczyk M | title = Viral proteases as targets for drug design | journal = Current Pharmaceutical Design | volume = 19 | issue = 6 | pages = 1126–53 | date = 2013 | pmid = 23016690 | doi=10.2174/13816128130613}}</ref><ref>{{cite journal | vauthors = Yilmaz NK, Swanstrom R, Schiffer CA | title = Improving Viral Protease Inhibitors to Counter Drug Resistance | journal = Trends in Microbiology | volume = 24 | issue = 7 | pages = 547–557 | date = July 2016 | pmid = 27090931 | pmc = 4912444 | doi = 10.1016/j.tim.2016.03.010 }}</ref>。 |
|||
=== 菌類<!-- Fungus --> === |
|||
* [[マイタケ]] - [[マイタケプロテアーゼ]]を含む。 |
* [[マイタケ]] - [[マイタケプロテアーゼ]]を含む。 |
||
* [[麹]] |
* [[麹]] |
||
| 44行目: | 98行目: | ||
* [[クモノスカビ]] |
* [[クモノスカビ]] |
||
== |
==利用<!-- Uses -->== |
||
{{main|en:Proteases (medical and related uses)}} |
|||
* [[納豆菌]] - [[ナットウキナーゼ]]を含む。 |
|||
プロテアーゼ研究の分野は広大である。2004年以降、この分野に関連する論文は毎年約8000本が発表されている<ref>{{cite book| first1 = Alan J | last1 = Barrett | first2 = Neil D | last2 = Rawlings | first3 = J Fred | last3 = Woessnerd | name-list-style = vanc |title=Handbook of proteolytic enzymes|year=2004|publisher=Elsevier Academic Press|location=London, UK|isbn=978-0-12-079610-6|edition=2nd}}</ref>。プロテアーゼは、産業、医療、生物学で基礎研究ツールとして利用されている<ref>{{cite book| veditors = Hooper NM |title=Proteases in biology and medicine|year=2002|publisher=Portland Press|location=London|isbn=978-1-85578-147-4}}</ref><ref>{{cite journal|last=Feijoo-Siota|first=Lucía|last2=Villa | first2 = Tomás G. | name-list-style = vanc |title=Native and Biotechnologically Engineered Plant Proteases with Industrial Applications|journal=Food and Bioprocess Technology|date=28 September 2010|volume=4|issue=6|pages=1066–1088|doi=10.1007/s11947-010-0431-4}}</ref>。 |
|||
消化プロテアーゼ<!-- digestive proteases -->は、多くの[[洗濯洗剤]]で使われる成分であり、また、パン業界では{{仮リンク|生地改良剤|en|Dough conditioner|label=}}として広く使用されている。さまざまなプロテアーゼが、その本来の機能 (たとえば、血液凝固を制御) または完全に人工的な機能 (たとえば、病原性タンパク質の標的破壊) の両方のために医学的に使用されている。[[TEVプロテアーゼ]]や[[トロンビン]]などの非常に特異的なプロテアーゼは、一般的に[[融合タンパク質]]や[[タンパク質タグ]]を制御された方法で切断するために使用される。 |
|||
== 脚注 == |
|||
{{脚注ヘルプ}} |
|||
{{Reflist}} |
|||
==阻害剤<!-- Inhibitors -->== |
|||
== 参考文献 == |
|||
{{main|プロテアーゼ阻害剤 (生物学)|en:Protease inhibitor (pharmacology)}} |
|||
{{節スタブ}} |
|||
プロテアーゼの活性は、[[プロテアーゼ阻害剤 (生物学)|プロテアーゼ阻害剤]]によって阻害される<ref>{{cite journal | vauthors = Southan C | title = A genomic perspective on human proteases as drug targets | journal = Drug Discovery Today | volume = 6 | issue = 13 | pages = 681–688 | date = July 2001 | pmid = 11427378 | doi = 10.1016/s1359-6446(01)01793-7 }}</ref>。プロテアーゼ阻害剤の一例として、[[セルピン]]スーパーファミリーがある。これには、[[α1-アンチトリプシン]] (自身の[[炎症]]性プロテアーゼの過剰な作用から体を保護する)、{{仮リンク|α1-アンチキモトリプシン|en|Alpha 1-antichymotrypsin|label=}} (同様に作用する)、{{仮リンク|C1-インヒビター|en|C1-inhibitor|label=}} (自身の[[補体系]]の過剰なプロテアーゼ誘発活性化から体を保護する)、{{仮リンク|アンチトロンビン|en|Antithrombin|label=}} (自身の過剰な[[凝固]]から体を保護する)、{{仮リンク|プラスミノーゲンアクチベーターインヒビター1|en|Plasminogen activator inhibitor-1|label=}} (自身のプロテアーゼ誘発[[繊維素溶解]]をブロックすることにより、不十分な凝固から身体を保護する)、および{{仮リンク|ニューロセルピン|en|Neuroserpin|label=}}を含む。 |
|||
天然プロテアーゼ阻害剤には、細胞の制御と分化に役割を果たす{{仮リンク|リポカリン|en|Lipocalin|label=}}タンパク質のファミリーが含まれる。リポカリンタンパク質に結合した[[親油性]]リガンドは、腫瘍プロテアーゼ阻害作用を有することが見出された。天然[[プロテアーゼ阻害剤 (生物学)|プロテアーゼ阻害剤]]を、抗レトロウイルス治療で使用される{{仮リンク|プロテアーゼ阻害剤 (薬理学)|en|Protease inhibitor (pharmacology)|label=プロテアーゼ阻害剤}}と混同してはならない。[[HIV|HIV/AIDS]]を含む一部の[[ウイルス]]は、生殖周期においてプロテアーゼに依存している。そのため、[[抗ウイルス薬|抗ウイルス]]手段としてプロテアーゼ阻害剤が開発されている。 |
|||
== 関連項目 == |
|||
<!-- {{Commonscat|}} --> |
|||
他の天然プロテアーゼ阻害剤は、生物の防衛機構として使用されている。一般的な例として、いくつかの植物の種子に含まれる{{仮リンク|トリプシン阻害剤|en|Trypsin inhibitor|label=}}は、人の主要な食用作物である大豆において最も顕著で、捕食者を思いとどまらせるために作用する。生大豆は、含まれているプロテアーゼ阻害剤が変性されるまで、人間を含む多くの動物に[[毒性]]がある。 |
|||
==参照項目<!-- See also -->== |
|||
* プロテアーゼ |
|||
**[[システインプロテアーゼ]] |
|||
**[[:en:serine protease|セリンプロテアーゼ]] |
|||
**{{仮リンク|スレオニンプロテアーゼ|en|Threonine protease|label=}} |
|||
**{{仮リンク|アスパラギン酸プロテアーゼ|en|Aspartic protease|label=}} |
|||
**{{仮リンク|グルタミン酸プロテアーゼ|en|Glutamic protease|label=}} |
|||
**[[:en:metalloprotease|メタロプロテアーゼ]] (金属プロテアーゼ) |
|||
* {{仮リンク|PAクラン|en|PA clan of proteases|label=}} |
|||
* [[:en:Convergent evolution|収斂進化]] |
|||
* [[タンパク質分解]] |
|||
* [[:en:Catalytic triad|触媒三残基]] |
|||
* {{仮リンク|タンパク質分解マップ|en|The Proteolysis Map|label=}} |
|||
* {{仮リンク|血管形成におけるプロテアーゼ|en|Proteases in angiogenesis|label=}} |
|||
* {{仮リンク|膜内プロテアーゼ|en|Intramembrane protease|label=}} |
|||
* {{仮リンク|プロテアーゼ阻害剤 (薬理学)|en|Protease inhibitor (pharmacology)|label=}} - 抗ウイルス薬のクラス |
|||
* [[プロテアーゼ阻害剤 (生物学)]] |
|||
* {{仮リンク|TopFIND|en|TopFIND|label=}} - プロテアーゼの特異性、基質、製品、阻害剤のデータベース |
|||
* {{仮リンク|MEROPS|en|MEROPS|label=}} - プロテアーゼの進化的グループのデータベース |
|||
* [[酵素]] |
* [[酵素]] |
||
* [[加水分解酵素]] |
* [[加水分解酵素]] |
||
| 61行目: | 136行目: | ||
* [[消化酵素]] |
* [[消化酵素]] |
||
* [[生姜牛乳プリン]] |
* [[生姜牛乳プリン]] |
||
* [[プロテアーゼ阻害剤 (生物学)]] |
|||
==脚注<!-- References -->== |
|||
== 外部リンク == |
|||
{{Reflist}} |
|||
* Merops - the peptidase database: http://merops.sanger.ac.uk/ |
|||
{{Biosci-stub}} |
|||
{{Medical-stub}} |
|||
==外部リンク<!-- External links -->== |
|||
{{Library resources box |
|||
|onlinebooks=no |
|||
|by=no}} |
|||
* [http://www.protease.org/ International Proteolysis Society] |
|||
* [http://merops.sanger.ac.uk/ MEROPS - the peptidase database] |
|||
* [http://www.sciencegateway.org/resources/protease.htm List of protease inhibitors] |
|||
* [http://www.expasy.org/tools/peptidecutter/ Protease cutting predictor] |
|||
* [http://www.expasy.org/tools/peptidecutter/peptidecutter_enzymes.html List of proteases and their specificities] (see also [http://www.expasy.org/cgi-bin/lists?peptidas.txt]) |
|||
* [https://web.archive.org/web/20081121051237/http://www.proteolysis.org/ Proteolysis MAP from Center for Proteolytic Pathways] |
|||
* [https://web.archive.org/web/20110903233056/http://cutdb.burnham.org/ Proteolysis Cut Site database - curated expert annotation from users] |
|||
* [https://web.archive.org/web/20081222011039/http://substrate.burnham.org/ Protease cut sites graphical interface] |
|||
* [http://clipserve.clip.ubc.ca/topfind TopFIND protease database covering cut sites, substrates and protein termini] |
|||
* {{MeshName|Proteases}} |
|||
{{authority control}} |
|||
{{デフォルトソート:ふろてあせ}} |
{{デフォルトソート:ふろてあせ}} |
||
[[Category:ペプチダーゼ|*]] |
[[Category:ペプチダーゼ|*]] |
||
[[Category:酵素]] |
[[Category:酵素]] |
||
[[Category:EC 3.4|*]] |
|||
2021年1月19日 (火) 10:49時点における版

プロテアーゼ (protease)は、タンパク質をより小さなポリペプチドや単一のアミノ酸への分解を触媒する (速度を上げる) 加水分解酵素の総称である。ペプチダーゼ (peptidase) やプロテイナーゼ(proteinase)とも呼ばれる。それらは、水が反応して結合を壊す加水分解によってタンパク質内のペプチド結合を切断する。プロテアーゼは、摂取したタンパク質の消化、タンパク質の異化作用 (古いタンパク質の分解)、細胞シグナル伝達など、多くの生物学的機能に関与している[1][2]。
プロテアーゼのような付加的な助力機構がない場合、タンパク質分解は非常に遅く、何百年もかかる反応である[3]。プロテアーゼは、植物、動物、バクテリア、古細菌などあらゆる形態の生命体やウイルスに見られる。それらは独立して収斂進化 (しゅうれんしんか) しており、異なるクラスのプロテアーゼは、完全に異なる触媒機構によって同じ反応を実行できる。
プロテアーゼの分類
触媒残基に基づく分類
プロテアーゼは大きく分けて7つのグループに分類される[4]。
- セリンプロテアーゼ - セリンアルコールを使用
- システインプロテアーゼ - システインチオールを使用
- スレオニンプロテアーゼ - スレオニン二級アルコールを使用
- アスパラギン酸プロテアーゼ - アスパラギン酸カルボン酸を使用
- グルタミン酸プロテアーゼ - グルタミン酸カルボン酸を使用
- メタロプロテアーゼ (金属プロテアーゼ) - 金属、通常は亜鉛を使用[1][2]
- アスパラギンペプチドリアーゼ - アスパラギンを使用して脱離反応を行う (水を必要としない)
プロテアーゼは、1993年に進化的関係に基づいて最初に84ファミリーに分類され、セリンプロテアーゼ、システインプロテアーゼ、アスパラギンプロテアーゼ、メタロプロテアーゼの4つの触媒型に分類された[5]。スレオニンプロテアーゼとグルタミン酸プロテアーゼは、それぞれ1995年と2004年まで記載されていなかった。ペプチド結合を切断する機構は、システインとスレオニンを持つアミノ酸残基 (プロテアーゼ) または水分子 (アスパラギン酸、メタロプロテアーゼ、酸プロテアーゼ) がペプチドカルボキシル基を攻撃できるように求核性にすることである。求核試薬を作成する一つの方法は、ヒスチジン残基を用いてセリン、システイン、またはスレオニンを求核剤として活性化させる触媒三残基である。ただし、求核試薬の種類はさまざまなスーパーファミリーで収斂進化しており、一部のスーパーファミリーは複数の異なる求核試薬への分岐進化を示しているため、これは進化的なグループではない。
ペプチドリアーゼ
2011年に、第7の触媒型のタンパク質分解酵素であるアスパラギンペプチドリアーゼが報告された。そのタンパク質分解機構は、加水分解ではなく、脱離反応を行う珍しいものである[6]。この反応では、触媒アスパラギンは、適切な条件下でタンパク質中のアスパラギン残基でそれ自体を切断する環状の化学構造を形成する。その根本的に異なる機構を考えると、ペプチダーゼに含まれるかどうかは議論の余地があ[6]る。
進化的な系統
プロテアーゼの進化的スーパーファミリーの最新の分類は、MEROPSデータベースにある[7]。このデータベースでは、プロテアーゼを構造、機構、触媒残基の順序に基づいて、最初に「クラン」(clan、タンパク質のスーパーファミリー) によって分類している (例: PAクランはPが求核性ファミリーの混合物を示す)。各「クラン」内でプロテアーゼは、配列類似性に基づいてファミリーに分類される (例: PAクラン内のS1とC3ファミリー)。各ファミリーには、何百もの関連プロテアーゼ (例: S1ファミリー内のトリプシン、エラスターゼ、トロンビンおよびストレプトグリシンなど) が含まれる場合がある。
現在、50以上のクランが知られており、それぞれがタンパク質分解の独立した進化的起源を示している[7]。
最適pHに基づく分類
また、プロテアーゼは、それらが活性を発揮する最適なpHによって分類されることもある。
- 酸性プロテアーゼ
- I型過敏症に関与する中性プロテアーゼ。ここでは、肥満細胞から放出され、補体やキニンの活性化を引き起こす[8]。このグループにはカルパインが含まれる。
- 塩基性プロテアーゼ (またはアルカリ性プロテアーゼ)
酵素の機能・機構
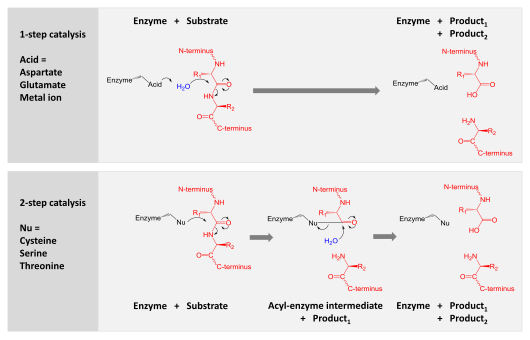
プロテアーゼは、アミノ酸残基をつなぐペプチド結合を分割させることで、長いタンパク質鎖をより短い断片に消化することに関与している。
今日では切断位置によるエキソペプチダーゼとエンドペプチダーゼの分類が広く用いられる[9]。
- エキソペプチダーゼ - タンパク質鎖から末端アミノ酸を切り離す。基質のN末端から1残基ずつ切断する酵素をアミノペプチダーゼ、C末端側から1残基ずつ切断する酵素をカルボキシペプチダーゼと呼ぶ。
- エンドペプチダーゼ - タンパク質の内部ペプチド結合を攻撃、切断する。トリプシン、キモトリプシン、サブチリシン、ペプシン、パパイン、エラスターゼなど。
触媒作用
触媒作用 (英語版) は、2つの機構のいずれかによって達成される。
- アスパラギン酸、グルタミン酸、およびメタロプロテアーゼは、水分子を活性化し、ペプチド結合に求核攻撃を加えて加水分解する。
- セリン、スレオニン、およびシステインプロテアーゼは求核性残基を使用する (通常、触媒三残基)。その残基は、求核的な攻撃を実行してプロテアーゼを基質タンパク質に共有結合させ、生成物の前半を解放する。次に、この共有結合アシル酵素中間体は、活性化された水によって加水分解され、生成物の後半を解放し、遊離酵素を再生することによって触媒作用を完了する。
基質特異性
タンパク質分解は、非常に無差別 (英語版) な可能性があり、広範囲のタンパク質基質が加水分解される。これは、トリプシンのような消化酵素の場合で、摂取したタンパク質の配列をより小さなペプチド断片に切断できなければならない。無差別プロテアーゼは通常、基質上の単一のアミノ酸に結合するので、その残基に対してのみ特異性がある。例えば、トリプシンは、配列 ...K/.... または ...R/.... ('/'=切断部位) に特異的である[10]。
逆に、一部のプロテアーゼは非常に特異的であり、特定の配列を持つ基質だけを切断する。血液凝固 (トロンビンなど) およびウイルスポリンタンパク質処理 (TEVプロテアーゼなど) は、正確な切断イベントを達成するためにこのレベルの特異性を必要とする。これは、指定された残基に結合するいくつかのポケットを備えた長い結合溝またはトンネルを有するプロテアーゼによって達成される。たとえば、TEVプロテアーゼは配列 ...ENLYFQ/S... ('/'=切断部位) に特異的である[11]。
破壊と自己分解
プロテアーゼは、それ自体がタンパク質であるため、他のプロテアーゼ分子 (時には同じ種類の分子) によって切断される。これはプロテアーゼ活性の調節方法として機能する。一部のプロテアーゼは、自己分解(autolysis)後に活性が低下するが (TEVプロテアーゼなど) 、他のプロテアーゼは活性が高くなる (トリプシノーゲンなど)。
プロテアーゼの生物多様性
プロテアーゼは、原核生物から真核生物、ウイルスに至るまで、あらゆる生物に存在している。これらの酵素は、食物タンパク質の単純な消化から高度に制御されたカスケード (たとえば、血液凝固カスケード、補体系、アポトーシス経路、無脊椎動物のプロフェノールオキシダーゼ活性化カスケード) まで、多くの生化学的反応に関与している。プロテアーゼは、タンパク質のアミノ酸配列に応じて、特定のペプチド結合を切断する (限定的なタンパク質分解) か、またはペプチドをアミノ酸に完全に分解する (無制限なタンパク質分解) かのいずれかである。その活性は、破壊的な変化 (タンパク質の機能を破壊するか、またはその主成分に消化する)、機能の活性化、またはシグナル伝達経路のシグナルとなることがある。
植物
植物性レンネットと呼ばれるプロテアーゼを含む植物樹液は、ヨーロッパや中東で何百年にもわたってコーシャチーズやハラールチーズの製造に使用されてきた。ウィザニア・コアギュランス (Withania coagulans (英語版)) から採れる植物性レンネットは、インド亜大陸で消化不良や糖尿病のアーユルヴェーダ治療薬として何千年もの間使用されてきた。またパニールの原料としても使用される。
植物ゲノムは、大部分は未知の機能を持っている何百ものプロテアーゼを符号化している。機能がわかっているものは、主に発生調節に関与している[12]。植物プロテアーゼは光合成の調節にも関与している[13]。
植物には、プロテアーゼを豊富に含むものがある。
- パパイヤ - 果肉にパパインを含む。食肉の改質剤(軟化剤)としての利用も行われている。
- パイナップル - 果肉にブロメライン(ブロメリン)を含むため、大量に食べると舌に痺れを感じさせる。
- ショウガ - 根にジンギパイン(ジンギバイン)を含む。牛乳の凝固剤としての利用がある。
- イチジク - 果肉にフィカイン(フィシン)を含む。
- キウイフルーツ - 果肉にアクチニダイン(アクチニジン)を含む。
動物
プロテアーゼは、さまざまな代謝プロセスのために生物全体で使用されている。胃に分泌される酸性プロテアーゼ (ペプシンなど) や十二指腸に存在するセリンプロテアーゼ (トリプシンやキモトリプシン) によって食物中のタンパク質を消化することができる。血液中の血清中に存在するプロテアーゼ (トロンビン、プラスミン、ハーゲマン因子など) は、血液凝固や血栓の溶解、および免疫系の正しい働きに重要な役割を果たす。その他のプロテアーゼ (エラスターゼ、カテプシンG) は白血球に存在し、代謝制御においていくつかの異なる役割を果たす。ヘビ毒の中には、マムシの血毒素のようなプロテアーゼもあり、犠牲者の血液凝固カスケードを妨害する。プロテアーゼは、ホルモン、抗体、または他の酵素のような重要な生理学的役割を果たしている他のタンパク質の寿命を決定する。これは、生物の生理学における最も速い「スイッチオン」と「スイッチオフ」の調節機構の一つである。
複雑な協調作用により、プロテアーゼはカスケード反応として進行することがあり、その結果、生理学的シグナルに対する生物の応答の迅速かつ効率的な増幅される。
バクテリア
バクテリア (bacteria、細菌)は、タンパク質のペプチド結合を加水分解するためにプロテアーゼを分泌し、タンパク質を構成アミノ酸に分解する。タンパク質のリサイクルの中で、地球規模の炭素と窒素の循環にとって細菌や真菌のプロテアーゼは特に重要で、そのような活性はこれらの生物の栄養シグナルによって制御される傾向がある[14]。土壌中に存在する何千もの種の間でプロテアーゼ活性の栄養制御による正味の影響は、タンパク質が炭素、窒素、または硫黄の制限に応じて分解されるように、全体的な微生物群レベルで観察することができる[15]。
細菌には、変性タンパク質 (折りたたまれないまたは過って折りたたまれたタンパク質) を分解することにより、一般的なタンパク質の品質調整に関与するプロテアーゼ (たとえばAAA+プロテアソーム) が含まれている。
分泌された細菌性プロテアーゼはまた、外毒素として作用する可能性があり、細菌性病因の病原因子 (たとえば黄色ブドウ球菌の外毒素) の一例となりうる。細菌性外毒素プロテアーゼは、細胞外構造を破壊する。
納豆菌は、フィブリン (血栓の主成分) を溶解するナットウキナーゼを含有する。
ウイルス
一部のウイルスのゲノムは、1つの巨大なポリタンパク質を符号化しており、これを機能的な単位に切断するためにプロテアーゼが必要である (例えば、C型肝炎ウイルスやピコルナウイルス)。これらのプロテアーゼ (例えばTEVプロテアーゼ) は高い特異性を持ち、非常に限られた範囲で基質配列のセットのみを切断する[16]。したがって、これらのプロテアーゼは、プロテアーゼ阻害剤の一般的な標的である[17][18]。
菌類
- マイタケ - マイタケプロテアーゼを含む。
- 麹
- ケカビ
- クモノスカビ
利用
プロテアーゼ研究の分野は広大である。2004年以降、この分野に関連する論文は毎年約8000本が発表されている[19]。プロテアーゼは、産業、医療、生物学で基礎研究ツールとして利用されている[20][21]。
消化プロテアーゼは、多くの洗濯洗剤で使われる成分であり、また、パン業界では生地改良剤として広く使用されている。さまざまなプロテアーゼが、その本来の機能 (たとえば、血液凝固を制御) または完全に人工的な機能 (たとえば、病原性タンパク質の標的破壊) の両方のために医学的に使用されている。TEVプロテアーゼやトロンビンなどの非常に特異的なプロテアーゼは、一般的に融合タンパク質やタンパク質タグを制御された方法で切断するために使用される。
阻害剤
プロテアーゼの活性は、プロテアーゼ阻害剤によって阻害される[22]。プロテアーゼ阻害剤の一例として、セルピンスーパーファミリーがある。これには、α1-アンチトリプシン (自身の炎症性プロテアーゼの過剰な作用から体を保護する)、α1-アンチキモトリプシン (同様に作用する)、C1-インヒビター (自身の補体系の過剰なプロテアーゼ誘発活性化から体を保護する)、アンチトロンビン (自身の過剰な凝固から体を保護する)、プラスミノーゲンアクチベーターインヒビター1 (自身のプロテアーゼ誘発繊維素溶解をブロックすることにより、不十分な凝固から身体を保護する)、およびニューロセルピンを含む。
天然プロテアーゼ阻害剤には、細胞の制御と分化に役割を果たすリポカリンタンパク質のファミリーが含まれる。リポカリンタンパク質に結合した親油性リガンドは、腫瘍プロテアーゼ阻害作用を有することが見出された。天然プロテアーゼ阻害剤を、抗レトロウイルス治療で使用されるプロテアーゼ阻害剤と混同してはならない。HIV/AIDSを含む一部のウイルスは、生殖周期においてプロテアーゼに依存している。そのため、抗ウイルス手段としてプロテアーゼ阻害剤が開発されている。
他の天然プロテアーゼ阻害剤は、生物の防衛機構として使用されている。一般的な例として、いくつかの植物の種子に含まれるトリプシン阻害剤は、人の主要な食用作物である大豆において最も顕著で、捕食者を思いとどまらせるために作用する。生大豆は、含まれているプロテアーゼ阻害剤が変性されるまで、人間を含む多くの動物に毒性がある。
参照項目
- プロテアーゼ
- PAクラン
- 収斂進化
- タンパク質分解
- 触媒三残基
- タンパク質分解マップ
- 血管形成におけるプロテアーゼ
- 膜内プロテアーゼ
- プロテアーゼ阻害剤 (薬理学) - 抗ウイルス薬のクラス
- プロテアーゼ阻害剤 (生物学)
- TopFIND - プロテアーゼの特異性、基質、製品、阻害剤のデータベース
- MEROPS - プロテアーゼの進化的グループのデータベース
- 酵素
- 加水分解酵素
- 消化
- 消化酵素
- 生姜牛乳プリン
脚注
- ^ a b King, John V.; Liang, Wenguang G.; Scherpelz, Kathryn P.; Schilling, Alexander B.; Meredith, Stephen C.; Tang, Wei-Jen (2014-07-08). “Molecular basis of substrate recognition and degradation by human presequence protease”. Structure 22 (7): 996–1007. doi:10.1016/j.str.2014.05.003. ISSN 1878-4186. PMC 4128088. PMID 24931469.
- ^ a b Shen, Yuequan; Joachimiak, Andrzej; Rosner, Marsha Rich; Tang, Wei-Jen (2006-10-19). “Structures of human insulin-degrading enzyme reveal a new substrate recognition mechanism”. Nature 443 (7113): 870–874. doi:10.1038/nature05143. ISSN 1476-4687. PMC 3366509. PMID 17051221.
- ^ “Rates of Uncatalyzed Peptide Bond Hydrolysis in Neutral Solution and the Transition State Affinities of Proteases”. JACS 118 (26): 6105–6109. (July 1996). doi:10.1021/ja954077c.
- ^ Oda, Kohei (2012). “New families of carboxyl peptidases: serine-carboxyl peptidases and glutamic peptidases”. Journal of Biochemistry 151 (1): 13–25. doi:10.1093/jb/mvr129. PMID 22016395.
- ^ “Evolutionary families of peptidases”. The Biochemical Journal 290 ( Pt 1) (Pt 1): 205–18. (February 1993). doi:10.1042/bj2900205. PMC 1132403. PMID 8439290.
- ^ a b “Asparagine peptide lyases: a seventh catalytic type of proteolytic enzymes”. The Journal of Biological Chemistry 286 (44): 38321–8. (November 2011). doi:10.1074/jbc.M111.260026. PMC 3207474. PMID 21832066.
- ^ a b “MEROPS: the peptidase database”. Nucleic Acids Res. 38 (Database issue): D227–33. (January 2010). doi:10.1093/nar/gkp971. PMC 2808883. PMID 19892822.
- ^ Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (2007). Robbins Basic Pathology (8th ed.). Philadelphia: Saunders. pp. 122. ISBN 978-1-4160-2973-1
- ^ 「プロテアーゼ」、『岩波生物学辞典』第4版、岩波書店、1996年。
- ^ “Does trypsin cut before proline?”. Journal of Proteome Research 7 (1): 300–5. (January 2008). doi:10.1021/pr0705035. PMID 18067249.
- ^ “A tobacco etch virus protease with increased substrate tolerance at the P1' position”. PLOS One 8 (6): e67915. (2013-06-24). doi:10.1371/journal.pone.0067915. PMC 3691164. PMID 23826349.
- ^ “Plant proteases: from phenotypes to molecular mechanisms”. Annual Review of Plant Biology 59: 191–223. (2008). doi:10.1146/annurev.arplant.59.032607.092835. hdl:11858/00-001M-0000-0012-37C7-9. PMID 18257708.
- ^ “Senescence-dependent degradation of Lhcb3 is mediated by a thylakoid membrane-bound protease”. Journal of Plant Physiology 161 (10): 1157–70. (October 2004). doi:10.1016/j.jplph.2004.01.006. PMID 15535125.
- ^ “Nitrogen Starvation Promotes Biodegradation of N-Heterocyclic Compounds in Soil”. Soil Biology & Biochemistry 38 (8): 2478–2480. (2006). doi:10.1016/j.soilbio.2006.01.006.
- ^ “Proteolytic activity under nitrogen or sulfur limitation”. Appl. Soil Ecol. 568: 1–5. (2002).
- ^ Tong, Liang (2002). “Viral Proteases”. Chemical Reviews 102 (12): 4609–4626. doi:10.1021/cr010184f. PMID 12475203.
- ^ “Viral proteases as targets for drug design”. Current Pharmaceutical Design 19 (6): 1126–53. (2013). doi:10.2174/13816128130613. PMID 23016690.
- ^ “Improving Viral Protease Inhibitors to Counter Drug Resistance”. Trends in Microbiology 24 (7): 547–557. (July 2016). doi:10.1016/j.tim.2016.03.010. PMC 4912444. PMID 27090931.
- ^ Barrett, Alan J; Rawlings, Neil D; Woessnerd, J Fred (2004). Handbook of proteolytic enzymes (2nd ed.). London, UK: Elsevier Academic Press. ISBN 978-0-12-079610-6
- ^ Proteases in biology and medicine. London: Portland Press. (2002). ISBN 978-1-85578-147-4
- ^ Feijoo-Siota, Lucía; Villa, Tomás G. (28 September 2010). “Native and Biotechnologically Engineered Plant Proteases with Industrial Applications”. Food and Bioprocess Technology 4 (6): 1066–1088. doi:10.1007/s11947-010-0431-4.
- ^ “A genomic perspective on human proteases as drug targets”. Drug Discovery Today 6 (13): 681–688. (July 2001). doi:10.1016/s1359-6446(01)01793-7. PMID 11427378.
外部リンク
| プロテアーゼに関する 図書館収蔵著作物 |
- International Proteolysis Society
- MEROPS - the peptidase database
- List of protease inhibitors
- Protease cutting predictor
- List of proteases and their specificities (see also [1])
- Proteolysis MAP from Center for Proteolytic Pathways
- Proteolysis Cut Site database - curated expert annotation from users
- Protease cut sites graphical interface
- TopFIND protease database covering cut sites, substrates and protein termini
- Proteases - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
