腸管上皮
| Intestinal epithelium | |
|---|---|
 単層円柱上皮細胞 | |
| 表記・識別 | |
| MeSH | D007413 |
| FMA | 17229、15695 |
| 解剖学用語 | |
腸管上皮(ちょうかんじょうひ、英: intestinal epithelium)は、消化器の小腸と大腸(結腸)の管腔表面(内壁)を形成する単層細胞層である。腸管上皮は単層円柱上皮細胞から構成され、体内への有用な物質の吸収、そして有害な物質の進入の制限という主に2つの機能を果たす。防護機能の1つとして、腸管上皮は腸粘膜バリアの重要な構成要素を形成している。腸管上皮の機能的欠陥は、特定の疾患や症状の原因となる。また、さまざまな疾患や症状によってその機能不全が引き起こされ、さらなる合併症の原因となる場合もある。
構造
[編集]腸管上皮は腸粘膜の一部を構成する。上皮は単層の細胞から構成され、粘膜を構成する他の2層である粘膜固有層と粘膜筋板が上皮層を支持しまとめている。腸管内腔の内容物を確実に保持するため、上皮層の細胞はタイトジャンクションによって連結されており、連続的な比較的透過性の低い膜構造が形成されている。
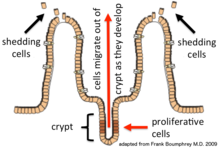

上皮細胞は細胞分裂、成熟、移動の過程によって4–5日周期で常に再生されている。再生は腸腺(上皮が下部の結合組織へ陥入している部分)の陰窩(底部)に位置する増殖性細胞(幹細胞)に依存している[1]。新たな細胞は底部で形成され、上方へ移動して陰窩を出る。その過程で成熟が進行する。そして最終的に、アポトーシスによって腸管内腔へ剥離する[2]。このようにして、腸管の内壁は常に再生されている一方で、上皮層を構成する細胞数は一定に維持されている[3]。
小腸では、粘膜層は栄養素の吸収を最大化するために表面積を広げる特殊な適応が生じている。こうした吸収面の拡大は3つの解剖学的特徴によって達成されており、その結果、単純な円筒構造と比較してその表面積は600倍となっている[4]。
- 輪状襞は内壁に輪状に存在する襞であり、内腔の内容物の通過を遅らせ、表面積を3倍に拡大する。
- 絨毛と腸腺は粘膜の表面積を10倍に拡大する。
- 微絨毛はエンテロサイトの頂端側表面を覆い、吸収面を20倍拡大する。直径100 nmの指型の突起が無数に存在しており、波打つ刷子縁を形成している。
上皮細胞の頂端側表面の刷子縁はグリコカリックスで覆われている。グリコカリックスは膜糖タンパク質や糖脂質に連結されたオリゴ糖から構成されている[5]。

細胞種
[編集]陰窩の底部に位置する幹細胞によって、6種類(または7種類)の細胞種が生み出される。各細胞種は上方に移動して陰窩を出る過程で、それぞれ固有の分化プログラムに従って成熟する。各上皮細胞種への分化に必要な遺伝子の多くが同定され、特性解析がなされている(腸管上皮分化遺伝子の一覧を参照)。生み出される細胞種は、エンテロサイト(腸細胞、吸収細胞)、杯細胞、腸管内分泌細胞、パネート細胞、M細胞、タフト細胞、そしてcup cell(ただしモルモット、ウサギ、サルでのみ記載されている[6])である。これらの細胞種の機能を下に示す[6]。
- エンテロサイトは最も多く存在し、主な機能は栄養素の吸収である。エンテロサイトは内腔側表面に多くの異化酵素を発現しており、こうした酵素は内腔の分子を細胞内への取り込みに適したサイズへ分解している。エンテロサイトでは、イオン、水、単糖、ビタミン、脂質、ペプチド、アミノ酸などが吸収される。
- 杯細胞は粘液層を分泌し、管腔の内容物から上皮を保護する。
- 腸管内分泌細胞は、セクレチン、パンクレオザイミン、エンテログルカゴンなどさまざまな消化管ホルモンを分泌する。腸管内分泌細胞の一部は神経とシナプス結合しており[7]、neuropod cellと呼ばれる[8]。
- パネート細胞は、α-ディフェンシンなどの抗菌ペプチドを産生する[9][10]。
- M細胞は内腔から抗原を取り込み、MALTへ送達する。小腸では、M細胞はパイエル板と関係している。
- タフト細胞は免疫応答に関与している[11]。
- Cup cellは機能未知である。
消化管の各領域の機能ごとに各上皮細胞種の分布は異なっている[3]。
細胞結合の構造的構成要素
[編集]
腸管上皮がバリア機能を果たすためには上皮を構成する細胞がしっかりと連結されていることが重要であり、次の4種類の超構造レベルの細胞結合が観察される[12][13]。
ギャップジャンクション
[編集]ギャップジャンクションは隣接する細胞を2 nm以内の距離に保持する。ギャップジャンクションはコネキシン遺伝子ファミリーによってコードされるいくつかの相同なタンパク質群が多タンパク質複合体を形成することで構築される。この複合体の分子構造は六量体である。複合体は連結された細胞の細胞膜に埋め込まれており、六量体の中央にはギャップ(チャネル)が形成される。このチャネルを介してさまざまな分子やイオン、電気インパルスが2つの細胞間で受け渡される[14]。
デスモソーム
[編集]デスモソームはカドヘリンファミリーの膜貫通型細胞接着分子から構成され、細胞骨格を介して隣接細胞を連結する[15]。デスモソームによって細胞間には30 nmの隙間が形成される[14]。
アドヘレンスジャンクション
[編集]アドヘレンスジャンクションは接着帯(zonula adherens)とも呼ばれ、カテニンファミリーとカドヘリンファミリーのタンパク質によって形成される多タンパク質複合体である。この複合体は細胞間の接触点となる部分の細胞膜に位置している。この複合体は膜貫通タンパク質、細胞内のアダプタータンパク質、アクチン骨格から形成される。隣接細胞を連結する役割に加え、上皮の移動、細胞極性、その他の細胞結合複合体の形成の調節にも重要である[13]。
タイトジャンクション
[編集]タイトジャンクションは閉鎖帯(密着帯、zonula occludens)とも呼ばれ、腸管上皮のバリア機能に最も重要な構成要素である[16]。この複合体は主に、約35種類のタンパク質からなるクローディン・オクルディンファミリーのメンバーから構成され[12]、側底膜と頂端膜の境界付近で細胞周囲に連続的なベルト様のリングを形成している[13]。
隣接する細胞の膜貫通タンパク質の細胞外ドメインは互いに連結し、強固な密着を形成する。こうした相互作用には、同じ膜に埋め込まれたタンパク質の間で形成されるもの(「シス」)と隣接する細胞間で形成されるもの(「トランス」)がある。さらに、同一タンパク質間の相互作用(ホモフィリック、homophilic)も異なるタンパク質間での相互作用(ヘテロフィリック、heterophilic)もある[13]。
アドヘレンスジャンクションと同様、タイトジャンクションの細胞内ドメインはさまざまな足場タンパク質、アダプタータンパク質、シグナル伝達複合体と相互作用し、細胞骨格との連結、細胞極性、細胞シグナル伝達、小胞輸送を調節している[13]。
タイトジャンクションは、上皮層で隣接する細胞との間で狭いものの変化可能な密着構造を形成し、溶質の選択的透過を行う傍細胞輸送経路となる[13]。タイトジャンクションは以前は静的な構造であると考えられていたが、現在では動的な構造であり、細胞間の開口部のサイズを変化させることができることが知られている。これによって、さまざまな発生状態、生理、病理に適応している[16]。タイトジャンクションは上皮層の頂端部と側底部の境界部で選択的かつ半透性の傍細胞バリアとして機能しており、傍細胞空間を介して小さなイオンや水溶性溶質の通過を促進し、一方で管腔の抗原や微生物、毒素の通過を防いでいる[13]。
生理
[編集]腸管上皮は、運動性、そして協調的な消化、吸収、免疫、内分泌機能を促進する、複雑な解剖学的構造を有している[17]。
杯細胞から分泌される粘液は潤滑剤として機能し、粘膜の内容物による刺激から上皮細胞層を保護する役割を持つ。
歴史的に、陰窩細胞は主に分泌を行う細胞であり、エンテロサイトは主に吸収を行う細胞であると考えられてきた。しかしながら、近年の研究ではこうした古典的な機能分類に異議が唱えられており、表面細胞と陰窩細胞の双方が分泌と吸収の双方の機能を果たしており、分泌と吸収は同時に起こっていることが示されている[18][19]。
栄養素の取り込み
[編集]エンテロサイトの刷子縁を覆っているのはグリコカリックスであり、タンパク質や炭水化物の消化に必要不可欠な膜貫通型ヒドロラーゼやその他の酵素の側鎖のオリゴ糖から構成される、緩やかなネットワークである。こうした糖タンパク質や糖脂質、酵素は管腔内の炭水化物やタンパク質の最終的な消化段階を触媒する。こうして形成された単糖やアミノ酸は腸管上皮を越えて輸送され、最終的には血中へ輸送される[5]。
調節された選択的透過は、主に経細胞経路(細胞内経路、transcellular (transepithelial) route)と傍細胞経路(細胞間隙経路、paracellular route)の主に2つの経路で行われる[13]。
経細胞経路
[編集]
経細胞経路では、溶質は上皮細胞を経由して特異的に輸送される。この経路は主に、特定の電解質、アミノ酸、糖、短鎖脂肪酸やその他の分子を細胞内外へ輸送する、専用のトランスポーターの活性によって調節されている[13]。
傍細胞経路
[編集]傍細胞経路は、上皮細胞間に存在する空間を介した輸送に依存しており、細胞の内腔側の膜での細胞結合によって調節されている[13]。この経路は、水や溶質が腸管上皮を越えて受動的に輸送される主要な経路となっている。調節は細胞間のタイトジャンクションに依存しており、タイトジャンクションは傍細胞輸送に最も大きな影響を及ぼしている[20]。電子顕微鏡を用いた研究では、上皮層の電気抵抗はタイトジャンクション複合体の複雑さとフィラメントの数に依存していることが示されている[17]。また、細胞膜の抵抗と上皮細胞膜間のコンダクタンスも傍細胞経路の機能を調節する[17]。
機能
[編集]腸管上皮によって形成されるバリアは外部環境(腸管内腔の内容物)と体内を分離しており[13]、最も広くかつ重要な粘膜表面である[16]。
腸管上皮はいくつかの重要な機能を果たし、自然免疫系と獲得免疫系の双方に関与している。腸管上皮は細胞内外の環境をしっかりと監視して近隣細胞とコミュニケーションし、必要な場合には迅速に防御応答や修復機構を開始する[21]。バリアとして外来の抗原、毒素や微生物など有害な物質の進入を防ぐ一方で[12][13]、食物中の栄養素、電解質、水分やその他有用な物質に対しては腸管内腔からの取り込みを促進する選択性フィルターとして機能する[13]。
バリアの完全性が損なわれた場合には腸管透過性が亢進し、有害な物質が無制御に通過するようになる場合がある。その結果、腸自体やその他の器官において、個体の遺伝的素因に応じて炎症、感染症、アレルギー、自己免疫疾患やがんが引き起こされる場合がある[17]。
腸管上皮のエンテロサイトは消化系の一部としての機能が主要な役割である一方で、多様な微生物を認識して免疫系の機能に寄与するToll様受容体やNOD様受容体も発現している[22][23]。このように、腸管上皮は腸管内腔と体内を分離する物理的バリアとして機能しているだけでなく、内因性免疫の一部として病原体を認識する役割も果たしている。
ヒトの健康における重要性
[編集]腸管上皮の完全性の喪失は、炎症性腸疾患(IBD)の発症に重要な役割を果たしている[24]。腸内微生物叢の構成の変化は、IBD発症の重要な環境因子である。腸内微生物叢の有害な変化は不適切な(無制御な)免疫応答を誘導し、腸管上皮の損傷をもたらす。この腸管上皮という重要なバリアが突破されることで微生物の進入がさらに進行し、その結果さらなる免疫応答が引き起こされることとなる。IBDは多因子疾患であるが、腸内微生物に対する免疫応答の亢進による腸管バリア機能の欠陥がその進行を駆動する一因となっている[25]。
胆汁酸は消化管内腔の正常な構成要素であり、そこで生理的な界面活性剤、そして腸管上皮の恒常性の調節因子として作用している[26]。一方、腸管上皮細胞の胆汁酸への過剰な長期間の曝露は酸化ストレスの原因となり、DNAの酸化損傷や発がん性変異を引き起こす可能性がある[27]。
出典
[編集]- ^ Clevers H (2013). “The intestinal crypt, a prototype stem cell compartment.”. Cell 154 (2): 274–84. doi:10.1016/j.cell.2013.07.004. PMID 23870119.
- ^ van der Flier, Laurens G.; Clevers, Hans (2009-01-01). “Stem cells, self-renewal, and differentiation in the intestinal epithelium”. Annual Review of Physiology 71: 241–260. doi:10.1146/annurev.physiol.010908.163145. ISSN 1545-1585. PMID 18808327.
- ^ a b Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000-01-01). “Intestinal Architecture and Development”. Molecular Cell Biology (4th ed.). W. H. Freeman. ISBN 978-0716731368
- ^ Khurana (2005-01-01) (英語). Textbook Of Medical Physiology. Elsevier India. p. 641. ISBN 9788181478504
- ^ a b Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000-01-01) (英語). Transport across Epithelia.
- ^ a b Sarmento, Bruno (2015-09-30) (英語). Concepts and Models for Drug Permeability Studies: Cell and Tissue based In Vitro Culture Models. Woodhead Publishing. pp. 57–58. ISBN 9780081001141
- ^ Bohórquez, Diego; Liddle, Rodger (2015). “Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells”. Journal of Clinical Investigation 125 (2): 782–786. doi:10.1172/JCI78361. PMC 4319442. PMID 25555217.
- ^ Kaelberer, M. Maya; Bohórquez, Diego (2018). “A gut-brain neural circuit for nutrient sensory transduction”. Science 361 (6408): eaat5236. doi:10.1126/science.aat5236. PMC 6417812. PMID 30237325.
- ^ van Es, Johan H.; Clevers, Hans (2014-06-16). “Paneth cells”. Current Biology 24 (12): R547–548. doi:10.1016/j.cub.2014.04.049. ISSN 1879-0445. PMID 24937274.
- ^ Santaolalla R, Abreu MT (2012). “Innate immunity in the small intestine.”. Curr Opin Gastroenterol 28 (2): 124–9. doi:10.1097/MOG.0b013e3283506559. PMC 3502878. PMID 22241076.
- ^ Gerbe, F; Legraverend, C; Jay, P (September 2012). “The intestinal epithelium tuft cells: specification and function.”. Cellular and Molecular Life Sciences 69 (17): 2907–17. doi:10.1007/s00018-012-0984-7. PMC 3417095. PMID 22527717.
- ^ a b c Khan, Niamat; Asif, Abdul R. (2015-01-01). “Transcriptional Regulators of Claudins in Epithelial Tight Junctions”. Mediators of Inflammation 2015: 219843. doi:10.1155/2015/219843. ISSN 0962-9351. PMC 4407569. PMID 25948882.
- ^ a b c d e f g h i j k l m Groschwitz, Katherine R.; Hogan, Simon P. (2009-07-01). “Intestinal Barrier Function: Molecular Regulation and Disease Pathogenesis”. The Journal of Allergy and Clinical Immunology 124 (1): 3–22. doi:10.1016/j.jaci.2009.05.038. ISSN 0091-6749. PMC 4266989. PMID 19560575.
- ^ a b Bennett, M. V.; Barrio, L. C.; Bargiello, T. A.; Spray, D. C.; Hertzberg, E.; Sáez, J. C. (1991-03-01). “Gap junctions: new tools, new answers, new questions”. Neuron 6 (3): 305–320. doi:10.1016/0896-6273(91)90241-q. ISSN 0896-6273. PMID 1848077.
- ^ Nekrasova, Oxana; Green, Kathleen J. (2013-11-01). “Desmosome assembly and dynamics”. Trends in Cell Biology 23 (11): 537–546. doi:10.1016/j.tcb.2013.06.004. ISSN 0962-8924. PMC 3913269. PMID 23891292.
- ^ a b c Rao, Jaladanki N.; Wang, Jian-Ying (2010-01-01) (英語). Intestinal Architecture and Development. Morgan & Claypool Life Sciences.
- ^ a b c d Fasano, Alessio (2011-01-01). “Zonulin and Its Regulation of Intestinal Barrier Function: The Biological Door to Inflammation, Autoimmunity, and Cancer” (英語). Physiological Reviews 91 (1): 151–175. doi:10.1152/physrev.00003.2008. ISSN 0031-9333. PMID 21248165.
- ^ Geibel, John P. (2005-01-01). “Secretion and absorption by colonic crypts”. Annual Review of Physiology 67: 471–490. doi:10.1146/annurev.physiol.67.031103.153530. ISSN 0066-4278. PMID 15709966.
- ^ Binder, Henry J.; Rajendran, Vazhaikkurichi; Sadasivan, Vidyasagar; Geibel, John P. (2005-04-01). “Bicarbonate secretion: a neglected aspect of colonic ion transport”. Journal of Clinical Gastroenterology 39 (4 Suppl 2): S53–58. doi:10.1097/01.mcg.0000155521.81382.3a. ISSN 0192-0790. PMID 15758660.
- ^ Näslund, Erik; Hellström, Per M. (2007-09-10). “Appetite signaling: from gut peptides and enteric nerves to brain”. Physiology & Behavior 92 (1–2): 256–262. doi:10.1016/j.physbeh.2007.05.017. ISSN 0031-9384. PMID 17582445.
- ^ Cario, E (2010). “Heads up! How the intestinal epithelium safeguards mucosal barrier immunity through the inflammasome and beyond.”. Current Opinion in Gastroenterology 26 (6): 583–590. doi:10.1097/MOG.0b013e32833d4b88. PMID 20664345.
- ^ Cario, E (2005). “Bacterial interactions with cells of the intestinal mucosa: Toll-like receptors and NOD2.”. Gut 54 (8): 1182–93. doi:10.1136/gut.2004.062794. PMC 1774880. PMID 15840688.
- ^ Abreu, Maria T.; Fukata, Masayuki; Arditi, Moshe (2005-04-15). “TLR signaling in the gut in health and disease”. Journal of Immunology 174 (8): 4453–4460. doi:10.4049/jimmunol.174.8.4453. ISSN 0022-1767. PMID 15814663.
- ^ Maloy, Kevin J.; Powrie, Fiona (2011-06-16). “Intestinal homeostasis and its breakdown in inflammatory bowel disease”. Nature 474 (7351): 298–306. doi:10.1038/nature10208. ISSN 1476-4687. PMID 21677746. オリジナルの29 October 2019時点におけるアーカイブ。 8 December 2019閲覧。.
- ^ Coskun, Mehmet (2014-08-25). “Intestinal Epithelium in Inflammatory Bowel Disease”. Frontiers in Medicine 1: 24. doi:10.3389/fmed.2014.00024. ISSN 2296-858X. PMC 4292184. PMID 25593900.
- ^ Ajouz, Hana; Mukherji, Deborah; Shamseddine, Ali (2014-05-24). “Secondary bile acids: an underrecognized cause of colon cancer”. World Journal of Surgical Oncology 12: 164. doi:10.1186/1477-7819-12-164. ISSN 1477-7819. PMC 4041630. PMID 24884764.
- ^ Bernstein, Harris; Bernstein, Carol (2023-01). “Bile acids as carcinogens in the colon and at other sites in the gastrointestinal system”. Experimental Biology and Medicine (Maywood, N.J.) 248 (1): 79–89. doi:10.1177/15353702221131858. ISSN 1535-3699. PMC 9989147. PMID 36408538.
