リンゴ酸-アスパラギン酸シャトル
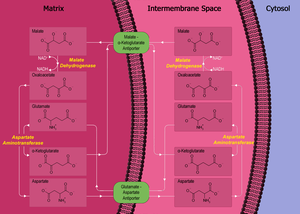
リンゴ酸-アスパラギン酸シャトル(Malate-aspartate shuttle)は、真核生物における酸化的リン酸化のため、解糖系で生成した電子を半透過性のミトコンドリア内膜を通して移動させる生化学系である。この電子は、ミトコンドリアの電子伝達系に入ってATPを生成する。ミトコンドリア内膜は、電子伝達系の主要な還元剤であるNADHを通さないため、シャトル系が必要である。これを回避するために、リンゴ酸が膜を通過して還元剤を運ぶ。
構成[編集]
シャトルは、以下の4つのタンパク質を含む。
- ミトコンドリアマトリックスや膜間空間に含まれるリンゴ酸脱水素酵素
- ミトコンドリアマトリックスや膜間空間に含まれるアスパラギン酸アミノ基転移酵素
- 細胞質基質に含まれるリンゴ酸-α-ケトグルタル酸アンチポーター
- 内膜に含まれるグルタミン酸-アスパラギン酸アンチポーター
メカニズム[編集]
リンゴ酸-アスパラギン酸シャトルで最も重要な酵素は、リンゴ酸脱水素酵素である。リンゴ酸脱水素酵素は、シャトル系において、ミトコンドリアと細胞質基質の2カ所に存在する。2種類のリンゴ酸脱水素酵素は、その位置と構造が異なり、この過程において、逆方向の反応を触媒する。
まず細胞質基質に存在するリンゴ酸脱水素酵素は、オキサロ酢酸とNADHからリンゴ酸とNAD+を生成する。この過程で、2つの電子がオキサロ酢酸に結合してリンゴ酸を生成する。
リンゴ酸が形成されると、最初のアンチポーターであるリンゴ酸-α-ケトグルタル酸アンチポーターがリンゴ酸を細胞質基質からミトコンドリアのマトリックスに運び、同時にα-ケトグルタル酸をマトリックスから細胞質基質に運び出す。リンゴ酸はミトコンドリアのマトリックスに到着した後に、ミトコンドリアのリンゴ酸脱水素酵素によってオキサロ酢酸に変換され、同時にNAD+が2つの電子を得て還元され、NADHとH+が生成する。その後オキサロ酢酸はミトコンドリアのアスパラギン酸アミノ基転移酵素によってアスパラギン酸に変換される。アスパラギン酸はアミノ酸であるため、オキサロ酢酸にアミノラジカルが結合する必要がある。これはグルタミン酸によって供給され、グルタミン酸は同じ酵素によってα-ケトグルタル酸に変換される。
2つめのアンチポーターであるグルタミン酸-アスパラギン酸アンチポーターは、グルタミン酸を細胞質基質からマトリックスに運び、アスパラギン酸をマトリックスから細胞質基質に運び出す。アスパラギン酸は細胞質基質に到着した後、細胞質基質のアスパラギン酸アミノ基転移酵素によってオキサロ酢酸に変換される。
リンゴ酸-アスパラギン酸シャトルの正味の効果は、純粋な酸化還元である。細胞質基質のNADHは酸化されてNAD+になり、マトリックスのNAD+は還元されてNADHになる。その後細胞質基質のNAD+は、次の解糖系によって還元されうる状態になり、マトリックスのNADHは、ATPを合成するため電子を電子伝達系に渡すのに用いられる。
リンゴ酸-アスパラギン酸シャトルは、ミトコンドリアのマトリックス内でNADHを再生するため、解糖系によるATP生産の数を最大化することができ(NADH1個当たり3個)、最終的にはグルコース1分子当たり正味38分子のATPが生成する。これは、FAD+を還元してFADH2を生成し、電子伝達系のキノンプールに電子を供給してNADH1分子当たり2分子のATPを生成して、最終的にグルコース1分子当たり正味36分子のATPを生成するグリセロール-3-リン酸シャトルに匹敵する。
出典[編集]
- Monty Krieger; Matthew P Scott; Matsudaira, Paul T.; Lodish, Harvey F.; Darnell, James E.; Lawrence Zipursky; Kaiser, Chris; Arnold Berk. Molecular Cell Biology, Fifth Edition. San Francisco: W. H. Freeman. ISBN 0-7167-4366-3
