シスプラチン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 胎児危険度分類 |
|
| 法的規制 | |
| 投与経路 | 点滴静注 |
| 薬物動態データ | |
| 生物学的利用能 | - |
| 血漿タンパク結合 | 98%(24時間) |
| 代謝 | - |
| 半減期 | 20〜30分 |
| 排泄 | 尿中 |
| 識別 | |
| CAS番号 | 15663-27-1 |
| ATCコード | L01XA01 (WHO) |
| PubChem | CID: 84691 |
| DrugBank | APRD00359 |
| KEGG | D00275 |
| 化学的データ | |
| 化学式 | Cl2H6N2Pt |
| 分子量 | 300.05 |
シスプラチン(cisplatin : CDDP)は白金錯体に分類される抗悪性腫瘍剤(抗がん剤)。シスプラチンの「シス」は、立体化学の用語のシスに由来する。錯体の中心金属は白金、配位子はアンミンと塩化物イオンであり、物質名はシス-ジアミンジクロロ白金(II)(cis-diamminedichloro-platinum(II)、cis-[PtCl2(NH3)2])である。なお、日光によって分解されるため、直射日光を避けて保存する必要があり、点滴にかかる時間を長く取る必要がある場合は点滴容器の遮光が必要となることもある。世界保健機関 (WHO) の下部組織によるIARC発がん性リスク一覧のグループ2に属する。ヒトに対する発癌性の限られた証拠、動物実験での十分な証拠がある。
商品名は、ブリプラチン(ブリストル・マイヤーズ)、ランダ(日本化薬)など。白金製剤としては、ほかにカルボプラチン、ネダプラチン、オキサリプラチンがある。 薬理作用を発現するのはシス型だけでトランス型は抗がん作用を示さない。
開発経緯
シスプラチンは、1845年にイタリアの化学者ミケーレ・ペイローネ(Michele Peyrone、1813-1883年)により錯体の研究材料として合成され[1]、「ペイロン塩(Peyrone's salt)」と呼ばれた。
1965年、アメリカ合衆国のバーネット・ローゼンバーグ(w:Barnett Rosenberg)らは、細菌に対して電場が及ぼす影響を調べている時に、偶然プラチナ電極の分解産物が大腸菌の増殖を抑制し、フィラメントを形成させることを発見した。その後1969年には、ローゼンバーグらにより白金化合物の大腸菌に対する細胞分裂阻止作用を応用して癌細胞の分裂抑制に対する研究が行われ、その結果ペイロン塩、つまりシスプラチンが動物腫瘍において比較的広い抗腫瘍スペクトルを有する化合物であることが判明した。
1972年にはアメリカ国立癌研究所(NCI)の指導で臨床試験が開始されたが、強い腎毒性のため、いったんは開発が中断された。しかし、その後シスプラチン投与時に大量の水分負荷と、さらに利尿薬を使用することによって腎障害を軽減することが可能となった。その後の臨床開発により、1978年にカナダ、アメリカ等で承認され、1983年に日本で承認された。
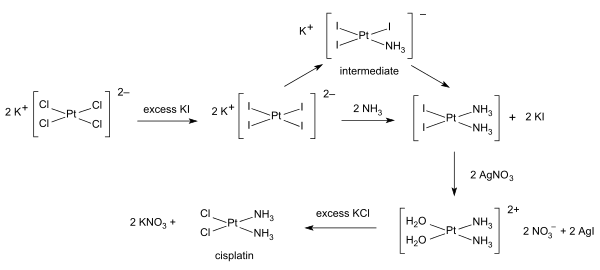
合成経路
シスプラチンの合成反応は、トランス効果の典型例である[2]。まず、テトラクロリド白金(II)酸カリウム([PtCl4]2−)を出発物質とする。最初のNH3基は4つのCl基どれとも無作為に置換される。しかし、Cl−はNH3より大きなトランス効果を持ち、そのトランス位を置換活性とするため、NH3基の置換は、すでに存在しているNH3基に対してトランスの位置にはあまりおこらず、Cl基のトランスの位置におきやすい。したがって、2番目のNH3基はシス型に置換される。一方、[Pt(NH3)4]2+が出発物質であれば、Cl基のトランス効果のため2番目のCl基は最初のCl基のトランスの位置に入り、生成物はトランス型になる。
作用機序
シスプラチンは、DNAの構成塩基であるグアニン、アデニンのN-7位に結合する。2つの塩素原子部位でDNAと結合するため、DNA鎖内には架橋が形成される。シス体に比べ、トランス体は架橋が形成されにくいため、投与量の制限により臨床的に用いることはできない。
シスプラチン抵抗
シスプラチンを使った癌治療は最近では多く見られるが、患者の多くは服用後しばらくしてからシスプラチン抵抗の強い病に苦しむ事が多い。抵抗のメカニズムとして、細胞外への薬の流出、薬の無効化、アポトーシスの抑圧、DNA修復の補助等がある。研究所内の実験においてはシスプラチン抵抗のある癌細胞には活発なオキサリプラチンが多く見られるが、患者の癌細胞にも同じ現象が起きている事を証明する事実は少ない。[3]シスプラチン抵抗のある癌細胞の治療にはパクリタキセルが有効と思われるが、そのメカニズムはまだ明らかになっていない。[4]
効能・効果
- 睾丸腫瘍、膀胱癌、腎盂・尿管腫瘍、前立腺癌、卵巣癌、頭頸部癌、非小細胞肺癌、食道癌、子宮頸癌、神経芽細胞腫、胃癌、小細胞肺癌、骨肉腫、胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)
- 悪性胸膜中皮腫・・ペメトレキセドと併用
- 以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
- M-VAC療法(シスプラチン、メトトレキサート、ビンブラスチン及びドキソルビシンとの併用療法)
禁忌:重篤な腎障害
主な副作用
腎毒性
- 発現機序
- シスプラチンは主に近位尿細管細胞を障害する。
- 対処法
- 腎組織内でのシスプラチン濃度を低下させ、毒性を軽減することを目的に水分負荷(水分を与えておくこと、ハイドレーションとも言う)及び強制利尿を行う。このため投与時は尿量を調べることが必須となる。総投与量が 300〜700 mg/m2 までは腎機能障害の発現頻度は低いとされている。なお、フロセミドによる強制利尿を行う場合には腎障害、聴器障害が増強されることがあるので、輸液等による水分補給を十分に行うことが重要となる。
悪心・嘔吐
- 発現機序
- 延髄外側網様体に位置する嘔吐中枢が刺激されて発現する。
- 対処法
- 急性の悪心・嘔吐に対しては、オンダンセトロン、グラニセトロン、アザセトロンといった5-HT3受容体拮抗薬を投与することにより、発現を大幅に減少させることができる。遅延性の嘔吐や予測性の嘔吐に対しては、メチルプレドニゾロンやデキサメタゾン等のステロイドホルモンと5-HT3受容体拮抗薬あるいはメトクロプラミド等との併用が臨床的によく用いられている。
聴器毒性
- 症状
- 聴力低下、難聴、耳鳴り
- 発現機序
- 蝸牛の外側有毛細胞の障害と考えられ、総投与量で300mg/m2 以上になると発現頻度が高くなる。
- 対処法
- 不可逆的であり、根本的な治療法は見つかっていない。障害が軽度な場合は投与中止で改善する可能性もあるので、定期的な聴力検査(オーディオグラム)を行い、障害の徴候があらわれたら、投与継続の是非を考慮する必要がある。
溶血性貧血
- 原因
- 長期間に渡るシスプラチンの服用が原因であり、体内にある抗体がシスプラチンと反応して溶血を引き起こすとされている。[5]
神経毒性
- 症状
- シスプラチンの服用前と服用後の検査によって神経への損傷が示唆されており、主な症状として視覚障害や聴覚障害が上げられる。シスプラチンはDNAの複製を妨げ、アポトーシスを引き起こす事によって効果を発揮するが、これが神経障害の原因となっているとは証明されていない。最近の研究によってシスプラチンはNHE-1という酵素の働きを弱める事によって体内の電解質の均衡を崩す他、細胞骨格を変える事が明らかになった。ただしこれは服用量によって左右される。[6]
適用上の注意
調製時の注意
- 本剤を点滴静注する際、塩化物イオン濃度が低い輸液を用いるとSN2反応で加水分解し、細胞内に到達する前に、輸液中で塩化物イオンが水に置換した活性型となってしまい、腎毒性が現れやすくなるとともに、細胞内に入りにくくなってしまうため、必ず塩化物イオンがある程度含まれる輸液を用いること。また、この機序を利用した低張シスプラチン療法というものが考案された事もある[7]。
関連事項
脚注
- ^ Michele Peyrone (1813–1883), Discoverer of Cisplatin, "Platinum Metals Review", 2010, 54, (4) 250-256
- ^ Alderden, Rebecca A.; Hall, Matthew D.; Hambley, Trevor W. (2006). “The Discovery and Development of Cisplatin”. J. Chem. Educ. 83 (5): 728. doi:10.1021/ed083p728.
- ^ Stordal B, Davey M (November 2007). "Understanding cisplatin resistance using cellular models". IUBMB Life 59 (11): 696–9. doi:10.1080/15216540701636287. PMID 17885832.
- ^ Stordal B, Pavlakis N, Davey R (December 2007). "A systematic review of platinum and taxane resistance from bench to clinic: an inverse relationship". Cancer Treat. Rev. 33 (8): 688–703. doi:10.1016/j.ctrv.2007.07.013. PMID 17881133.
- ^ Levi JA, Aroney RS, Dalley DN (June 1981). "Haemolytic anaemia after cisplatin treatment". Br Med J (Clin Res Ed) 282 (6281): 2003–4. doi:10.1136/bmj.282.6281.2003. PMC 1505958. PMID 6788166.
- ^ Milosavljevic N, Duranton C, Djerbi N, Puech PH, Gounon P, Lagadic-Gossmann D, Dimanche-Boitrel MT, Rauch C, Tauc M, Counillon L, Poët M (2010). "Nongenomic effects of cisplatin: acute inhibition of mechanosensitive transporters and channels without actin remodeling". Cancer Res. 70 (19): 7514–22. doi:10.1158/0008-5472.CAN-10-1253. PMID 20841472. /releases/2010/10/101005141117.htm Lay summary Check |laysummary= value (help) – ScienceDaily.
- ^ Katano K. “Pharmacokinetics of hypotonic cisplatin chemotherapy administered into the peritoneal and the pleural cavities in experimental model.”. 2011年11月4日閲覧。
外部リンク
参考資料
- 『ブリプラチン®注』医薬品インタビューフォーム・新様式第2版(ブリストル・マイヤーズ)