エバスチン
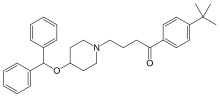 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com |
国別販売名(英語) International Drug Names |
| 投与経路 | Oral |
| 薬物動態データ | |
| 血漿タンパク結合 | Greater than 95% |
| 代謝 | Hepatic (CYP3A4-mediated), to carebastine |
| 半減期 | 15 to 19 hours (carebastine) |
| 識別 | |
| CAS番号 |
90729-43-4 |
| ATCコード | R06AX22 (WHO) |
| PubChem | CID: 3191 |
| ChemSpider |
3079 |
| UNII |
TQD7Q784P1 |
| ChEMBL | CHEMBL305660en:Template:ebicite |
| 化学的データ | |
| 化学式 | C32H39NO2 |
| 分子量 | 469.658 g/mol |
| |
エバスチン(Ebastine)は大日本住友製薬が開発した抗ヒスタミン薬(ヒスタミンH1受容体拮抗薬)の一つである。商品名エバステルで知られる。
血液脳関門をほとんど通過しないので、末梢組織でH1受容体を阻害する濃度で中枢神経系の副作用(鎮静、傾眠等)を起こす事が少ない[1][2][3]。
水溶性が低いので、微粒子化技術が応用されることが多い。
効能・効果[編集]
エバスチンは第二世代のH1受容体阻害薬である。日本では5mg錠と10mg錠、ならびにOD錠(口腔内崩壊錠;5mg、10mg)が販売されている。海外では10mg錠、20mg錠[6]、速崩錠[7]、小児用シロップが入手できる。
薬物動態[編集]
経口投与後、肝臓の酵素CYP3A4で初回通過効果を受けて活性代謝物(カルボン酸体であるカレバスチン)となる。この変換はほぼ100%である。

有効性[編集]
40以上の臨床試験の8,000名以上の患者[出典無効]のデータから、間欠性アレルギー性鼻炎、持続性アレルギー性鼻炎、その他の効能・効果での有効性が示されている[3][5][6][8][9][10]。
副作用[編集]
重大な副作用として添付文書に記載されているものは、 ショック、アナフィラキシー様症状、肝機能障害、黄疸である[4]。
エバスチンは認知機能・精神運動性に影響を与えず[6]、鎮静効果も偽薬を超えない[6]。またQT延長症候群を引き起こす事がない[6]。有害事象の発現率は偽薬と同程度で良好な安全性を有しているとされる。
動物での試験の結果では胎児への影響を示さず、ヒトでの報告例もない。乳汁中に移行するか否かは知られていない[2]。
一般用医薬品[編集]
2014年1月20日、興和からエバステルALが発売された[11]。処方箋医薬品が一般用医薬品に転用(スイッチOTC)された例である。2018年1月5日に、要指導医薬品から第二類医薬品に変更された[12]。
5mg錠のみの販売。就寝前に1日1回1錠の服用[13]。
出典[編集]
- ^ Tagawa, M; Kano, M; Okamura, N (2001). “Neuroimaging of histamine H1-receptor occupancy in human brain by positron emission tomography (PET): a comparative study of ebastine, a second-generation antihistamine, and (+)-clorphrniramine, a classical antihistamine”. Br J Clin Pharmacol 52 (5): 501–509. doi:10.1046/j.1365-2125.2001.01471.x. PMC 2014616. PMID 11736858.

- ^ a b Dinnendahl, V, Fricke, U, ed (2010) (German). Arzneistoff-Profile. 4 (23 ed.). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-98-46-3
- ^ a b Bousquet, J; Gaudaño, EM; Palama Carlos, AG (1999). “A 12-week, placebo-controlled study of the efficacy and safety of ebastine, 10 and 20 mg once daily, in the treatment of perennial allergic rhinitis”. Allergy 54 (6): 562–568. doi:10.1034/j.1398-9995.1999.00984.x. PMID 10435469.
- ^ a b “エバステル錠5mg/エバステル錠10mg/エバステルOD錠5mg/エバステルOD錠10mg 添付文書” (2016年1月). 2016年6月28日閲覧。
- ^ a b Van Cauwenberge, P; de Belder, T; Sys, L (2004). “A review of the second-generation antihistamine ebastine for the treatment of allergic disorders”. Exp Rew Pharmacother 5 (8): 1807–13. doi:10.1517/14656566.5.8.1807. PMID 15264995.
- ^ a b c d e Sastre, J (2008). “Ebastine in allergic rhinitis and chronic idiopathic urticaria”. Allergy 63 (Suppl 89): 1–20. doi:10.1111/j.1398-9995.2008.01897.x. PMID 19032340.
- ^ Antonijoan, R; García-Gea, C; Puntes, M (2007). “Comparison of inhibition of cutaneous histamine reaction of ebastine fast-dissolving tablet (20 mg) versus desloratadine capsules (5 mg): a randomized, double-blind, double-dummy, placebo-controlled, three period crossover study in healthy, nonatopic adults”. Clin Ther 29 (5): 814–22. doi:10.1016/j.clinthera.2007.05.001. PMID 17697901.
- ^ Ratner, P; Falqués, M; Chuecos, F (2005). “Meta-analysis of the efficacy of ebastine 20 mg compared to loratadine 10 mg and placebo in the symptomatic treatment of seasonal allergic rhinitis”. Int Arch Allergy Immunol 138 (4): 312–8. doi:10.1159/000088869. PMID 16224195.
- ^ Antonijoan, RM; García-Gea, C; Puntes, M (2007). “A comparison of ebastine 10 mg fast-dissolving tablet with oral desloratadine and placebo in inhibiting the cutaneous reaction to histamine in healthy adults”. Clin Drug Invest 27 (7): 453–61. doi:10.2165/00044011-200727070-00002. PMID 17563125.
- ^ Gehanno, P; Bremard-Oury, C; Zeisser, P (1996). “Comparison of ebastine to cetirizine in seasonal allergic rhinitis in adults”. Annals of Allergy, Asthma and Immunol 76 (6): 507–12. doi:10.1016/S1081-1206(10)63269-3. PMID 8673684.
- ^ “アレルギー専用鼻炎薬「エバステルAL」 新発売”. 興和株式会社. 2022年4月3日閲覧。
- ^ “エバスチン、トラニラストが第2類に移行”. 日経BP. 2022年4月3日閲覧。
- ^ “エバステルAL”. 興和. 2022年4月3日閲覧。
- Salvà, M; Carreño, B; Pintos, M (2004). “Phase I, single dose, open label, randomized, crossover bioequivalence studies of ebastine 10 mg and 20 mg regular tablets vs 10 and 20 mg fast-dissolving tablets in healthy male volunteers”. J Invest Allergol Clin Immunol 14 (4 (Suppl 1)): S5.
- Peyri, J; Vidal, J; Marrón, J; Fonseca, E.; Suárez, E.; Ledo, A.; Zayas, J. M.; Luria, X. (1991). “Ebastine in chronic urticaria: a double-blind placebo controlled study”. J Dermatol Treat 2 (2): 51–3. doi:10.3109/09546639109086774.
外部リンク[編集]
- “KESTINE Package Insert”. South African Electronic Package Inserts (1997年10月24日). 2007年4月1日閲覧。
