Na+/K+-ATPアーゼ
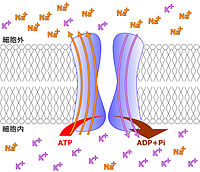
Na+/K+-ATPアーゼ(英語: Na+/K+-ATPase, NAKA)は、2種のサブユニットから成る細胞の膜輸送系の膜貫通タンパク質(EC 3.6.3.9)である。片仮名転記では、表記揺れでNa+/K+-ATPエースとも書かれる。この酵素は、細胞内でのATPの加水分解と共役して細胞内からナトリウムイオンを汲み出し、カリウムイオンを取り込むのでナトリウム-カリウムポンプ(Na+/K+ポンプ)または単にナトリウムポンプ(Na+ポンプ)とも呼ばれる。ヒトの全ての細胞で見られる共通のタンパク質である。
Na+/K+-ATPアーゼの発見[編集]
Na+/K+-ATPアーゼは1957年に、イェンス・スコウがデンマークのオーフス大学の生理学部助教授として勤務していた時期に発見した。1997年に、彼はナトリウム-カリウムポンプの発見の功績によりポール・ボイヤー、ジョン・E・ウォーカーと共に、ノーベル化学賞を受賞した。
作用[編集]
ポンプの作用を式にすると、次の通りである。
このようにして全ての細胞で、Na+とK+濃度の維持のために、わざわざATPを消費している。この結果、細胞内ではK+の濃度が高く、細胞外ではNa+が高い状態が保たれている [1] 。 Na+/K+-ATPアーゼは1回毎に、細胞内から3Na+を細胞外へ汲み出して、細胞外から2K+を細胞内へ汲み入れるため、その都度、正電荷を1個細胞外に放出する電位発生的な対向輸送を行っていると言える。
脂質二分子膜は水を透過するため、動物細胞はNa+/K+ポンプによって浸透圧と含水量を調節している。Na+/K+ポンプによって作られる膜電位(Em)は、ニューロンでは神経刺激になり、また別の細胞ではグルコースやアミノ酸の能動輸送の自由エネルギーを供給する。
なお、この目的のために、一般的な細胞では細胞内で合成したATPの3割程度を消費しており、ニューロンに至っては細胞内で合成したATPの7割も消費していると見積もられている。
ニューロンは細胞外からNa+を流入させて電気信号を送るため、細胞内の環境を維持するには、盛んにNa+を細胞外へと汲み出す必要があるためである [2] 。
構造[編集]

αサブユニット[編集]
αサブユニット(約1000残基)は、酵素活性を持ち糖鎖を持たないサブユニットである。各々の哺乳類のαサブユニットの配列は、約98パーセントが同一であり、約8本の膜貫通αヘリックスと2個の大きな細胞質ドメインで構成されると推定されている。
βサブユニット[編集]
βサブユニット(約300残基)は、糖鎖を持つサブユニットで、1本の膜貫通ヘリックスと大きな細胞外ドメイン構造が推定されている。機能は不明であり、なぜ2量体構造が必要であるのかも判っていない。
出典[編集]
- ^ 小林 静子・馬場 広子・平井 みどり(編集)『新しい機能形態学 ―ヒトの成り立ちとその働き―(第2版)』 p.7、p.13 廣川書店 2007年3月25日発行 ISBN 978-4-567-51561-0
- ^ 森本 武利・彼末 一之(編集)『やさしい生理学(改訂第5版)』 pp.162 - 166 南江堂 2005年10月1日発行 ISBN 978-4-524-23967-2

