分裂促進因子活性化タンパク質キナーゼ
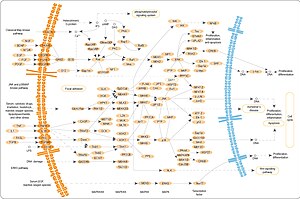
分裂促進因子活性化タンパク質キナーゼ(ぶんれつそくしんいんしかっせいかタンパクしつキナーゼ、英: Mitogen-activated Protein Kinase、MAPK、EC 2.7.11.24)とはセリン/スレオニンキナーゼの一つであり、何らかの刺激(酸化ストレス、サイトカインなど)を受けて活性化される。全身の細胞に広く発現しており、様々な細胞の機能発現において重要な働きをしている。単にMAP(マップ)キナーゼと略して呼ばれることが多い。
細胞外からの刺激が入ると低分子量Gタンパク質であるRasが活性化され、さらにその下流に続くシグナルカスケードの活性化が引き起こされる。また、MAPKホスファターゼ(MAPK Phosphatase: MKP)による脱リン酸化がMAPKを不活性化し、この機構に対して抑制的に働いている。
狭義には細胞外シグナル調節キナーゼ(英: Extracellular Signal-regulated Kinase、ERK)1/2のみを指すが、広義にはこれに加えてc-Jun N末端キナーゼ(英: c-jun N-terminal kinase、JNK)、p38 MAPK、ERK5およびERK7等の分子をも含み、MAPKファミリーとも呼ばれる。

ERK1/2(古典的MAPK)[編集]
ERK1/2はMAPKファミリーの中でも最初に同定されたものであり、古典的MAPKとも称される。ERK1/2は分子量が44kDaのERK1と42kDaのERK2から成り、これらのタンパク質のアミノ酸配列は互いに85%の相同性がある。
ERK1/2の活性化は以下のような機序で生じる。上皮増殖因子受容体(英: Epidermal Growth Factor Receptor、EGFR)等のチロシンキナーゼ関連型受容体にリガンドが結合すると受容体細胞内ドメインのリン酸化が生じる。Grb2等のSH2ドメインを含むアダプタータンパク質が受容体のリン酸化チロシンに結合すると、Grb2はSH3ドメインを介してSosと結合し、Sosを活性化させる[1]。活性化したSosはRasのGDP-GTP交換反応によりRasを活性化させる[2]。以下、RasはMAPキナーゼカスケードへとシグナルを伝えていくが、RasはMAPキナーゼキナーゼキナーゼ (MAPKKK) であるRafを、RafはMAPキナーゼキナーゼであるMAPK/ERK kinase (MEK) を活性化し、このMEKによりERKの活性化が引き起こされる。ERKの活性化にはThr183及びTyr185が重要な働きをしている。通常ERK1/2は細胞質に優位に存在するが、活性化されることにより核内へ移行して転写因子と相互作用することにより転写の制御を行っている。この経路はPD98059、U0126等の試薬によって阻害される。
新規MAPK[編集]
JNK[編集]
JNKはc-JunのSer63とSer73をリン酸化する活性を持つキナーゼとして同定された。JNKは放射線やリポ多糖 (LPS)、IL-1、浸透圧及び熱ショックなどのストレスにより活性化し、ストレス応答性MAPK (Stress-activated Protein Kinase、SAPK) とも呼ばれる。
JNK遺伝子にはJNK1-3が存在する。JNK1,2は全身の細胞に広く分布しているが、JNK3は主に神経系及び精巣において見られる[3]。
JNK1はアポトーシスや神経変性、細胞の分化・増殖、炎症性サイトカインの産生などの過程に関与している[4] 。JNKは様々な細胞内タンパク質のリン酸化を行い、それらの機能修飾をしている。SP600125によって阻害される。
p38 MAPK[編集]
p38MAPKはサイトカインによる刺激や紫外線照射、熱・浸透圧ストレスなどによって活性化されるプロテインキナーゼであり、Thr180/Tyr182のリン酸化がp38MAPKの活性化において重要な働きをしている。p38MAPKの遺伝子にはp38MAPKα,β,γ及びδの4種類が知られている。p38MAPKの上流にはMKK3やMKK6が存在する。SB203580により阻害される。
脚注[編集]
- ^ Schulze WX, Deng L and Mann M (2005). “Phosphotyrosine interactome of the ErbB-receptor kinase family”. Mol. Syst. Biol. 125.0008. doi:10.1038/msb4100012. PMC 1681463. PMID 16729043.
- ^ Zarich N, Oliva JL, Martínez N, Jorge R, Ballester A, Gutiérrez-Eisman S, García-Vargas S, Rojas JM (2006). “Grb2 is a negative modulator of the intrinsic Ras-GEF activity of hSos1”. Mol. Biol. Cell. 17 (8): 3591-3597. doi:10.1091/mbc.E05-12-1104. PMC 1525251. PMID 16760435.
- ^ Waetzig V and Herdegen T (2005). “Context-specific inhibition of JNKs: overcoming the dilemma of protection and damage”. Trends Pharmacol. Sci. 26 (9): 455-461. doi:10.1016/j.tips.2005.07.006. PMID 16054242.
- ^ Oltmanns U, Issa R, Sukkar MB, John M, Chung KF (2003). “Role of c-jun N-terminal kinase in the induced release of GM-CSF, RANTES and IL-8 from human airway smooth muscle cells”. Br. J. Pharmacol. 139 (6): 1228-1234. doi:10.1038/sj.bjp.0705345. PMC 1573939. PMID 12871843.
出典[編集]
- Bruce Alberts 著 "細胞の分子生物学 第4版" Garland Pub. 2004年 ISBN 4315517305
外部リンク[編集]
- MAPKシグナルパスウェイ - CSTジャパン
- 分裂促進因子活性化タンパク質キナーゼ - 脳科学辞典
