アダマンタン
| アダマンタン | |
|---|---|

| |

|

|

| |
別称 Tricyclo[3.3.1.13,7]decane | |
| 識別情報 | |
| CAS登録番号 | 281-23-2 |
| PubChem | 9238 |
| ChemSpider | 8883 |
| 日化辞番号 | J45.672A |
| ChEBI | |
| ChEMBL | CHEMBL1614830 |
| |
| |
| 特性 | |
| 化学式 | C10H16 |
| モル質量 | 136.23 g mol−1 |
| 外観 | 白色から淡白色の粉末 |
| 密度 | 1.08 g/cm3 (20 °C),[2]固体 |
| 融点 |
270 °C (543 K) |
| 沸点 |
昇華 |
| 水への溶解度 | 難溶性 |
| その他の溶媒への溶解度 | 炭化水素に可溶 |
| 屈折率 (nD) | 1.568[3] |
| 構造 | |
| 結晶構造 | 立方晶、空間群 Fm3m |
| 配位構造 | 4 |
| 双極子モーメント | 0 D |
| 危険性 | |
| 主な危険性 | 可燃性 |
| Sフレーズ | 24/25/28/37/45 |
| 関連する物質 | |
| 関連する化合物: | メマンチン リマンタジン アマンタジン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アダマンタン (独: adamantan、英: adamantane) は、10個の炭素がダイヤモンドの構造と同様に配置されている、かご型の分子である。化学式はC10H16、分子量は136.23。融点は270 °C。CAS登録番号は [281-23-2]。名称はダイヤモンドに相当するギリシャ語の "adamas" から名づけられたものである。単体は無色透明の結晶性固体で、樟脳様の臭気を有する。各炭素の結合角がsp3炭素の本来の角度(約109.5度)を成しているため全くひずみのない構造で、このため極めて安定である。対称性が高いため融点が高く、長らく炭化水素の高融点記録を保持していた。
1933年、チェコスロバキア産の原油から発見された。発見前の1924年にはデッカーにより存在の可能性が示唆されており、彼はこの物質を「デカテルペン (decaterpene)」と呼んでいた。
ジシクロペンタジエンから合成され、アダマンタン誘導体はフォトレジストや医薬品などの用途がある。
合成[編集]
分子式C10H16を持ち、ダイヤモンドに構造の似た炭化水素分子が存在する可能性は、ヘルマン・デッカー によって1924年の学術会議で提案されていた[4]。デッカーはこの分子を「デカテルペン」と呼び、いまだ合成されていないことを突然に示した。
アダマンタンの合成は難航した。実験室での合成を最初に試みたのは1924年のドイツの化学者ハンス・メールワインで、ピペリジン存在下でホルムアルデヒドとマロン酸ジエチルを反応させたが、1,3,5,7-テトラカルボメトキシビシクロ[3.3.1]ノナン-2,6-ジオン (1) を得るにとどまった。この化合物はのちに「メールワインエステル」と名づけられ、アダマンタンやその誘導体の合成に使われた[5]。その後、もう1人のドイツ人化学者ベトガー (D. Böttger) がメールワインエステルを使ってアダマンタン合成を試みたがこれも成功せず、得られたのはトリシクロ[3.3.1.13,7]デカン環を持つアダマンタンの誘導体であった[6]。
他にも、フロログルシノールやシクロヘキサノンの誘導体を使ってアダマンタンの合成を試みた研究者はいたが、いずれも失敗に終わっていた[7]。
最初にアダマンタンの合成に成功したのは1941年、ウラジミール・プレローグで、メールワインエステル 1 を出発物質とした[8][9]。合成過程は複雑で、5つの段階を含み、全過程の収率はおよそ0.16%に過ぎなかった。しかしながらこの方法は、アダマンタンの特定の誘導体を合成するのに、その後もときどき使われた[7]。プレローグの方法は1956年に改善され、脱炭酸の収率がハインスデッカーの経路を採用することにより11%に増えるとともに、収率24%のホフマン反応により、総収率は6.5%となったが[10][11]、この方法はまだ複雑すぎるものであった。
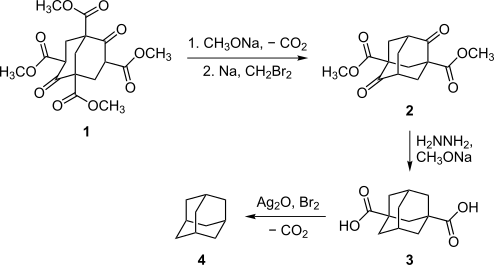
1957年にパウル・フォン・ラーゲ・シュライアーが、より簡便な方法を偶然発見した[12][13]。すなわち、ジシクロペンタジエンを触媒(酸化白金など)の存在下で水素化して C10H16 の分子式を持つ炭化水素(テトラヒドロジシクロペンタジエン)とし、これを塩化アルミニウムなどのルイス酸と加熱することによりヒドリドを引き抜き、発生したカルボカチオンが次々と転位を起こすことによって最終的に最も安定なアダマンタン骨格を得る、というものである。この方法は収率を30%-40%に増加し、アダマンタンの効率的な供給法を提供することとなった。これによりアダマンタンの性質の解明が進展した。現在でも実験室的製法として用いられている。その後アダマンタン合成の収率は60%まで伸び[14]、こんにちでは1グラムあたり1ドル程度の価格で購入できる化合物となっている。この合成法では反応後に多量のタールと塩化アルミニウムの混合物が発生するため日本国内では工業化できず、中国で合成されている。出光興産はゼオライトを触媒に用いる新たなアダマンタン合成プロセスを開発した[15]。このプロセスでは処理の困難な廃棄物が出ず、環境負荷が大幅に低減されており、プラントは山口県に建設され、2008年1月に商業運転を開始した。

これらの合成方法ではいずれも、アダマンタンは多結晶質の粉末として得られる。この粉末から、溶融法や溶液法、ブリッジマン・ストックバッカー法などの気相法で単結晶を作ることができる。溶融法ではモザイク状でX線回折が約1°の質の悪い結晶ができる。最も良い結晶は溶液法で得られるが、成長が遅く、数箇月かかって5-10ミリメートルの結晶ができる程度である。気相法は速さと質の両方に優れ[2]、炉の中に置いた石英管中でアダマンタンの昇華が行われる。炉には1センチあたり約 10 °C の温度勾配がかかるように加熱機が備えられており、管の一端はアダマンタンの融点近くに温度が保たれていて、ここで結晶化が起こる。温度勾配を維持しながら管全体をゆっくり冷ますと、結晶化の起こる位置が徐々にずれていき(1時間に2ミリ程度)、単結晶のブールが得られる[16]。
天然での存在[編集]

合成が行われる前、アダマンタンはチェコの化学者ランダ (S. Landa) とマカチェック (V. Macháček) によって、1933年に原油から単離されていた。彼らは分別蒸留という手法を単離に用いた。すなわち、原油の試料を油状の固体不純物が残るまで徐々に熱し、得られる蒸気を分別蒸留用のカラムに通す。カラムの温度は上方ほど低くなるので、蒸気がカラムを昇るにつれ、原油に含まれる炭化水素成分は、それぞれの沸点の位置で凝集する。この方法でランダとマカチェックは数ミリグラムのアダマンタンを得たに過ぎなかったが、その沸点と融点の高さに注目した。そして、この新たに得た化合物の構造はダイアモンドに類似すると考え、「アダマンタン」と名づけた[7][17]。
現在のところ、原油が唯一の天然に存在するアダマンタン源である。含有量は油田によって異なるが0.0001%から0.03%であり、商業製造には少なすぎる[18][19]。
アダマンタンのほかに、原油中には30種類以上のアダマンタン誘導体が含まれる[18]。原油は炭化水素などの複雑な混合物であるが、これらの誘導体は融点が高く、水蒸気蒸留ができ、安定なチオ尿素付加物を作るため、分離することが可能である。
物理的性質[編集]
純粋なアダマンタンは無色の結晶で、樟脳のようなにおいを持つ。水にはほとんど溶けないが、非極性の有機溶媒によく溶ける[20]。融点は炭化水素としては非常に高い 270℃ である。同じ分子量の炭化水素の融点は、カンフェン 45℃、リモネン -74℃、オシメン 50℃、テルピネン 60℃、ツイスタン 164℃、直鎖状のデカンは -28℃ である。しかし、アダマンタンは室温においてもゆっくりと昇華する[21]。アダマンタンは水蒸気蒸留することができる[19]。
構造[編集]

アダマンタン分子は3つのいす型シクロヘキサン環からなる。分子構造の数値は電子線回折やX線結晶構造解析で決定されている。炭素−炭素結合長は 154 pm でダイヤモンドとほぼ等しい。炭素−水素結合長は 111.2 pm である[3]。
結晶は通常の条件では面心立方格子構造をとり(空間群は Fm3m で a = 9.426 ± 0.008 Å)、単位格子中に4個の分子を含む。分子の向きは結晶中でばらばらである。208 K まで冷やすか0.5ギガパスカル以上の圧力をかけると体心正方格子構造となり(a = 6.641 Å、c = 8.875 Å)、単位格子中には2個の分子が含まれる[7][21]。
この相転移は速度論的に1次であり、熱容量のアノマリー(偏差)や弾性などの性質を伴う。特に、面心立方格子構造では分子が自由に回転するのに対し、体心正方格子構造では向きが固定化される。密度は 1.08 から 1.18 g/cm3 まで段階的に増加し、エントロピー変化は大きく 1594 J/(mol·K) である[2]。
硬さ[編集]
アダマンタンの弾性定数は、数センチ程度の大きな結晶で超音波エコー法により測定されている。弾性テンソル C11 の値は、結晶面 <110>、<111>、<100> について、それぞれ7.52、8.20、6.17ギガパスカルと求められている[16]。ダイヤモンドでの対応する値は、それぞれ1161、1174、1123ギガパスカルである[22]。アダマンタンとダイヤモンドでは炭素原子の位置は同じだが[23]、アダマンタンの場合はダイヤモンドのように共有結合で格子が固定されておらず、ファンデルワールス力により結びついているに過ぎないため、アダマンタンの結晶は柔らかく可塑性を持つ[2][16][24]。
分光学[編集]
| 波数 cm−1 | 帰属† |
|---|---|
| 2930 | CH2 の ν(C−H) |
| 2910 | CH2 の ν(C−H) |
| 2850 | CH2 の ν(C−H) |
| 1458 | δ(HCH) |
| 1356 | δ(HCC), ω(CH2) |
| 1312 | ν(C-C), ω(CH2) |
| 1103 | δ(HCC) |
| 970 | ρ(CH2), ν(C−C), δ(HCC) |
| 798 | ν(C−C) |
| 638 | δ(CCC) |
| 444 | δ(CCC) |
† 記号の意味
| |
核磁気共鳴 (NMR) スペクトルでは1位と2位に対応する分離の悪い2本のシグナルを示す。重クロロホルム中の1H NMRは 1.756 ppm と 1.873 ppm に、13C NMRは28.46 ppmと37.85 ppmにピークを示す[25]で見ることができる。アダマンタンのNMRスペクトルの単純さは純度を示すよい指標となる。すなわち、置換基を持つ誘導体は対称性が低いため、スペクトルはより複雑になる。
質量分析ではアダマンタンや誘導体は C10H16+ イオンに対応する m/z = 136 に特徴的なピークを示す。開裂により m/z = 93、80、79、67、41、39 にフラグメントイオンのピークが現れる[3][25]。
赤外分光では、分子の対称性が高いためスペクトルが単純である[3]。
光学活性[編集]
もしアダマンタンの各頂点にそれぞれ異なる置換基があると、分子はキラルとなり光学活性を持つ。ビフェニルの例と同じく、キラル中心は特定の炭素原子ではない[26]。1969年に、実際に4種の異なる置換基(水素原子、臭素原子、メチル基、カルボキシル基)を持つアダマンタンが合成されている。比旋光度は小さく、普通は1°以下である[27][28]。
命名法[編集]

系統的命名法に従えばトリシクロ[3.3.1.13,7]デカンとなるが、「アダマンタン」が優先IUPAC名 (PIN) である[29]。
アダマンタン分子は炭素原子と水素原子のみからなり、Td の対称性を持つ。分子中の16個の水素と10個の炭素は、2種の位置、1位(4箇所)か2位(6箇所)のどちらかに必ず属すことになる。
構造が近い化合物に、CH2 が1個少ないノルアダマンタンや、1個多いホモアダマンタンがある。
化学的性質[編集]
普通、σ結合(単結合)だけを持つ炭化水素は化学的に不活性だが、アダマンタンやその誘導体は反応性が高く、特にカルボカチオンを中間体として含むイオン反応を起こしやすい。
アダマンチルイオン[編集]
アダマンチルイオン(アダマンタンのカチオン)は1-フルオロアダマンタンを五フッ化アンチモン SbF5 と反応させることにより生成する。これは通常の3級イオンなどの他のカルボカチオンよりも安定性が高い[30][31]。

アダマンタンのジカチオンは超酸の溶液中で発生させることができ、三次元芳香族性のため、高い安定性を持つ[32]。
反応[編集]
反応はほとんどの場合、炭素原子が3配位である1位で起こる。2配位である2位は反応性が低い。2位での反応として、アダマンタンと濃硫酸の反応によるアダマンタノンの合成が知られている[33]。

アダマンタノンのカルボニル基はさらに反応させることができる。たとえば、アダマンタノンは2-アダマンタンカルボニトリル[34]や2-メチルアダマンタン[35]の原料となる。
臭素化[編集]
アダマンタンは臭素分子のような臭素化試薬と容易に反応する。生成物の組成や比率は反応の条件、特に触媒によって変化する[18]。

アダマンタンを沸騰している臭素と反応させると、臭素が1個置換した1-ブロモアダマンタンが得られる。ルイス酸を触媒として加えると、複数の臭素が置換した生成物が得られる[36]。臭素化の速度はルイス酸によって増加するが、光照射やフリーラジカルの添加では変化しないため、反応はイオン機構によって進行することが示されている[7]。
フッ素化[編集]
アダマンタンのフッ素化は、当初1-ヒドロキシアダマンタンや1-アミノアダマンタンを出発物質として用いていた[37]。のちにアダマンタンそのものからの合成も成功している[38]。これらの合成では、反応はアダマンタンのカチオンの生成と、それに対するフッ素求核剤の結合という過程を経る。アダマンタンとフッ素ガスの直接反応によるフッ素化も報告されている[39]。
カルボキシル化[編集]
アダマンタンのカルボキシル化は1960年に初めて報告され、ギ酸をカルボキシル化試薬、四塩化炭素を溶媒とするものであった[40]。

アダマンチルイオンを発生させるため、tert-ブチルアルコールと硫酸を加える。次に、系中でギ酸と硫酸から発生した一酸化炭素がこれと反応し、カルボキシル化が起こる[7]。1-アダマンタンカルボン酸の収率は56%-61%である[41]。
ヒドロキシル化[編集]
最も単純なアダマンタンのアルコール体である1-ヒドロキシアダマンタンは、含水アセトン中での1-ブロモアダマンタンの加水分解により容易に得られる。オゾンとの反応でアダマンタンから直接合成することもできる[42]。

その他[編集]
アダマンタンはルイス酸の存在下にベンゼンとフリーデル・クラフツ反応を起こす[43]。芳香族置換基を持つアダマンタン誘導体は、1-ヒドロキシアダマンタンを原料として容易に得られる。特にアニソールとの反応は、触媒を必要とせずに進行する[36]。
アダマンタンのニトロ化は収率の高くない、難しい反応である[44]。窒素原子が置換した医薬品であるアマンタジンの合成では、第1段階でアダマンタンに臭素分子または硝酸を反応させ、1位が臭素原子またはニトロエステルで置換された生成物を得る。これらの化合物をアセトニトリルと反応させるとアセトアミド体ができ、これを加水分解することでアマンタジン(1-アミノアダマンタン)が得られる[45]。

用途[編集]
アダマンタンそのものは官能基を持たない炭化水素に過ぎないため[46]、用途は多くないが、ドライエッチングのマスク[47]やポリマーの配合剤として利用される。
また、分子の形状が球形に近いため、固体中でも分子が比較的自由に回転しているという性質から、固体核磁気共鳴分光法において、化学シフトの標準物質として一般的に使われる[48]。アダマンタンは真空紫外領域にしか吸収を持たず、大気中で光イオン化を起こさないため、色素レーザーでは利得媒体(レーザージャイロ)を長持ちさせるのに使われる。アダマンタンや、アダマンタンが連なったダイアモンドイドについて、光イオン化に必要なエネルギーが明らかにされている[49]。
アダマンタン誘導体は高い耐熱性、透明性、耐薬品性、潤滑性などの特異な性質を有するため様々な用途での利用が試みられてきた。特に ArF エキシマレーザーリソグラフィーのフォトレジスト材料として高い性能を示すことから、2-アダマンタノンなどのアダマンタン誘導体から合成される感光性樹脂の需要が拡大している。この市場では出光興産が約 70% のシェアを有しているとされる(出光興産推計)。
医薬品[編集]
アダマンタンについて医学的な用途は知られていないが、誘導体は医薬品となっている。最初に利用されたのはアマンタジンで、まず1967年にインフルエンザに効果がある抗ウイルス薬[50]、そしてパーキンソン病の治療薬[51][52]として認められた。医薬品として、他にメマンチン、リマンタジン、ドーパマンチン、トロマンタジン、ビルダグリプチン、カルマンタジンなどがある。アダマンタンを含むポリマーで、抗HIV薬として特許が取得されているものがある[53]。
開発中の用途[編集]
アダマンタンのアルキル化体には、圧力モーターの作業流体として使われているものがある[54]。アダマンタンを骨格とするポリマーはタッチパネルの被覆剤への利用が検討されており[55]、アダマンタンや同族体はナノテクノロジーへの応用が期待されている。たとえば、固体アダマンタンの持つ柔軟なかご状構造はゲスト分子を取り込むことができるため、人体に取り込ませたあと構造を壊すことにより、取り込まれた分子を放出させる、という機能を持たせることができる[14][56]。
アダマンチル基[編集]
官能基としてはアダマンチル基(略号 Ad)と呼ばれ、安価に入手できる嵩高い官能基としてカルベンの安定化などに用いられている[57]。
類縁体[編集]
アダマンタンと同様なかご状構造を持つ分子として、三酸化二リン P4O6、三酸化二ヒ素 As4O6、五酸化二リン (PO)4O6、五硫化二リン (PS)4S6、ヘキサメチレンテトラミン N4(CH2)6 がある[58]。テトラメチレンジスルホテトラミンはヒトに対する毒性が非常に高いため各国で使用が禁止されている殺鼠剤であるが、中国で違法に使用され、中毒事故が度々起きている。アダマンタンのケイ素類縁体であるシラアダマンタンが2005年に合成されている[59]。
天然に産するアダマンタン類縁体としては、有機ヒ素化合物であるアルセニシンA C3H6As4O3が挙げられる。この化合物は、ニューカレドニアに生息する海綿から発見された[60]。
-
アダマンタン
アダマンタンのかご構造は積み重ねて高次のダイヤモンドイドとすることができ、2個でジアマンタン C4H20、3-6個でそれぞれトリアマンタン C18H24、テトラマンタン C22H28、ペンタマンタン C26H32、ヘキサマンタン C26H30 などが知られている。これらの合成法はアダマンタンのものを応用でき、収量はずっと低いが原油から抽出することもできる。
この形式で3次元的にどこまでも炭素骨格がつながったものがダイヤモンドである。
出典[編集]
- ^ According to page 41 of a 2004 IUPAC guide (PDF) , adamantane is the "preferred IUPAC name."
- ^ a b c d Windsor, C. G.; Saunderson, D. H.; Sherwood, J. N.; Taylor, D.; Pawley, G. S. (1978). “Lattice dynamics of adamantane in the disordered phase”. Journal of Physics C: Solid State Physics 11 (9): 1741. doi:10.1088/0022-3719/11/9/013.
- ^ a b c d Bagrii, E.I. (1989) (Russian). Adamantanes: synthesis, properties, applications. Nauka. pp. 5-57. ISBN 5-02-001382-X
- ^ Decker, H. (1924). “Versammlung deutscher Naturforscher und Ärzte. Innsbruck, 21-27 September 1924”. Angewandte Chemie 37 (41): 795. doi:10.1002/ange.19240374102.
- ^ Radcliffe, Marc D.; Gutierrez, Alberto; Blount, John F.; Mislow, Kurt (1984). “Structure of Meerwein's ester and of its benzene inclusion compound” (PDF). Journal of the American Chemical Society 106 (3): 682. doi:10.1021/ja00315a037.
- ^ Coffey, S.; Rodd, S., ed (1969). Chemistry of Carbon Compounds. Vol. 2. Part C. New York: Elsevier
- ^ a b c d e f Fort, Raymond C., Jr.; Schleyer, Paul Von R. (1964). “Adamantane: Consequences of Diamondoid Structure”. Chemical Reviews 64 (3): 277-300. doi:10.1021/cr60229a004.
- ^ Prelog, V.; Seiwerth, R. (1941). “Über die Synthese des Adamantans”. Berichte 74 (10): 1644-1648. doi:10.1002/cber.19410741004.
- ^ Prelog, V.; Seiwerth, R. (1941). “Über eine neue, ergiebigere Darstellung des Adamantans”. Berichte 74 (11): 1769-1772. doi:10.1002/cber.19410741109.
- ^ “Über Verbindungen mit Urotropin-Struktur, VIII. Mitteil.: Neue Wege der Adamantan-Synthese”. Chemische Berichte 89: 1922-1926. (1956). doi:10.1002/cber.19560890820.
- ^ McKervey, M. (1980). “Synthetic approaches to large diamondoid hydrocarbons”. Tetrahedron 36 (8): 971. doi:10.1016/0040-4020(80)80050-0.
- ^ Schleyer, P. von R. (1957). “A Simple Preparation of Adamantane”. Journal of the American Chemical Society 79 (12): 3292-3292. doi:10.1021/ja01569a086.
- ^ Schleyer, P. von R.; Donaldson, M. M.; Nicholas, R. D.; Cupas, C. (1973). "Adamantane". Organic Syntheses (英語): 8.; Collective Volume, vol. 5, p. 16
- ^ a b Mansoori, G. Ali (2007). Molecular building blocks for nanotechnology: from diamondoids to nanoscale materials and applications. Springer. pp. 48-55. ISBN 0-387-39937-2
- ^ ゼオライト触媒によるアダマンタン製造プロセスを開発、出光興産株式会社、2004年6月21日
- ^ a b c Drabble, J. R.; Husain, A. H. M. (1980). “Elastic properties of adamantane single crystals”. Journal of Physics C: Solid State Physics 13 (8): 1377. doi:10.1088/0022-3719/13/8/008.
- ^ Landa, S.; Macháček, V. (1933). Collection of Czechoslovak Chemical Communications 5: 1.
- ^ a b c “Синтез производных адамантана” (Russian). Chemistry Department, Moscow State University. 2009年12月11日閲覧。
- ^ a b Bagriy, E. I. (1989). “Methods for hydrocarbon adamantane series”. Adamantane: Synthesis, properties, application. Moscow: Nauka. pp. 58-123. ISBN 5-02-001382-X
- ^ “Adamantane” (Russian). Encyclopedia of Chemistry. 2009年12月11日閲覧。
- ^ a b Vijayakumar, V. et al (2001). “Pressure induced phase transitions and equation of state of adamantane”. Journal of Physics: Condensed Matter 13 (9): 1961-1972. doi:10.1088/0953-8984/13/9/318.
- ^ Anastassakis, E.; Siakavellas, M. (1999). “Elastic and Lattice Dynamical Properties of Textured Diamond Films”. Physica status solidi (b) 215: 189. doi:10.1002/(SICI)1521-3951(199909)215:1<189::AID-PSSB189>3.0.CO;2-X.
- ^ Mansoori, Ali G. (2005). Principles of nanotechnology: molecular-based study of condensed matter in small systems. World Scientific. p. 12. ISBN 981-256-154-4
- ^ Wright, John Dalton (1995). Molecular Crystals. Cambridge University Press. p. 28. ISBN 0-521-47730-1
- ^ a b 国立研究開発法人産業技術総合研究所. “有機化合物のスペクトルデータベース SDBS”. 2018年2月21日閲覧。
- ^ Smith, Michael B.; March, J. (2007). March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.). Hoboken: John Wiley & Sons. p. 145. ISBN 978-0-471-72091-1
- ^ Applequist, J.; Rivers, P.; Applequist, D. E. (1969). “Theoretical and experimental studies of optically active bridgehead-substituted adamantanes and related compounds”. Journal of the American Chemical Society 91 (21): 5705-5711. doi:10.1021/ja01049a002.
- ^ Hamill, H.; McKervey, M. A. (1969). “The resolution of 3-methyl-5-bromoadamantanecarboxylic acid”. Chemical Communications (15): 864. doi:10.1039/C2969000864a.
- ^ IUPAC (2004). “Chapter P-2 Parent Hydrides” (PDF). IUPAC Preferred Names. p. 41
- ^ Schleyer, P. R.; Fort, R. C.; Watts, W. E. (1964). “Stable Carbonium Ions. VIII. The 1-Adamantyl Cation”. Journal of the American Chemical Society 86 (19): 4195-4197. doi:10.1021/ja01073a058.
- ^ Olah, George A.; Prakash, G. K. Surya; Shih, Joseph G.; Krishnamurthy, V. V.; Mateescu, Gheorge D.; Liang, Gao; Sipos, Gyorgy; Buss, Volker; Gund, Tamara M.; Schleyer, Paul v. R. (1985). “Bridgehead adamantyl, diamantyl, and related cations and dications”. Journal of the American Chemical Society 107 (9): 2764-2772. doi:10.1021/ja00295a032.
- ^ Smit, W. A.; Bochkov A. F.; Caple, R. (1998). Organic Synthesis: The Science Behind the Art. Cambridge: Royal Society of Chemistry. pp. 322-323. ISBN 9780854045440
- ^ Geluk, H. W.; Keizer, V. G. (1973). "Adamantanone". Organic Syntheses (英語). 53: 8.; Collective Volume, vol. 6, p. 48
- ^ Oldenziel, O. H.; Wildeman, J.; van Leusen, A. M. (1977). "2-Adamantanecarbonitrile". Organic Syntheses (英語). 57: 8.; Collective Volume, vol. 6, p. 41
- ^ Schleyer, P. R.; Nicholas, R. D. (1961). “The Preparation and Reactivity of 2-Substituted Derivatives of Adamantane”. Journal of the American Chemical Society 83 (1): 182-187. doi:10.1021/ja01462a036.
- ^ a b Nesmeyanov, A. N. (1969) (Russian). Basic Organic Chemistry. p. 664
- ^ Olah, George A.; Welch, John T.; Vankar, Yashwant D.; Nojima, Mosatomo; Kerekes, Istvan; Olah, Judith A. (1979). “Pyridinium poly(hydrogen fluoride): a convenient reagent for organic fluorination reactions”. Journal of Organic Chemistry 44 (22): 3872-3881. doi:10.1021/jo01336a027.
- ^ Olah, George A.; Shih, Joseph G.; Singh, Brij P.; Gupta, B. G. B. (1983). “Ionic fluorination of adamantane, diamantane, and triphenylmethane with nitrosyl tetrafluoroborate/pyridine polyhydrogen fluoride (PPHF)”. Journal of Organic Chemistry 48 (19): 3356-3358. doi:10.1021/jo00167a050.
- ^ Rozen, Shlomo; Gal, Chava (1988). “Direct synthesis of fluoro-bicyclic compounds with fluorine”. Journal of Organic Chemistry 53 (12): 2803-2807. doi:10.1021/jo00247a026.
- ^ Koch, Herbert; Haaf, W. (1960). “Direkte Synthese der Adamantan-carbonsäure-(1)”. Angewandte Chemie 72 (17): 628. doi:10.1002/ange.19600721710.
- ^ Koch, H.; Haaf, W. (1964). "1-Adamantanecarboxylic acid". Organic Syntheses (英語). 44: 1.; Collective Volume, vol. 5, p. 20
- ^ Cohen, Zvi; Varkony, Haim; Keinan, Ehud; Mazur, Yehuda (1979). "Tertiary alcohols from hydrocarbons by ozonation on silica gel: 1-adamantanol". Organic Syntheses (英語). 59: 176.; Collective Volume, vol. 6, p. 43
- ^ Chalais, Stéphane; Cornélis, André; Gerstmans, André; Kołodziejski, Wacław; Laszlo, Pierre; Mathy, Arthur; Métra, Pierre (1985). “Direct clay-catalyzed Friedel-Crafts arylation and chlorination of the hydrocarbon adamantane”. Helvetica Chimica Acta 68 (5): 1196-1203. doi:10.1002/hlca.19850680516.
- ^ Smith, George W.; Williams, Harry D. (1961). “Some Reactions of Adamantane and Adamantane Derivatives”. Journal of Organic Chemistry 26 (7): 2207-2212. doi:10.1021/jo01351a011.
- ^ Moiseev, I. K.; Doroshenko, R. I.; Ivanova, V. I. (1976). “Synthesis of amantadine via the nitrate of 1-adamantanol”. Pharmaceutical Chemistry Journal 10 (4): 450-451. doi:10.1007/BF00757832.
- ^ Garcia, J. C.; Justo, J. F.; Machado, W. V. M.; Assali, L. V. C. (2009). “Functionalized adamantane: building blocks for nanostructure self-assembly”. Phys. Rev. B 80: 125421. doi:10.1103/PhysRevB.80.125421.
- ^ US patented 6465137, Watanabe, Keiji et al., "Resist composition and pattern forming process", published 2001-07-05, issued 2002-10-15, assigned to Fujitsu
- ^ Morcombe, Corey R.; Zilm, Kurt W. (2003). “Chemical shift referencing in MAS solid state NMR”. Journal of Magnetic Resonance 162 (2): 479-486. doi:10.1016/S1090-7807(03)00082-X. PMID 12810033.
- ^ Lenzke, K.; Landt, L.; Hoener, M. et al. (2007). “Experimental determination of the ionization potentials of the first five members of the nanodiamond series”. Journal of Chemical Physics 127 (8): 084320. doi:10.1063/1.2773725. PMID 17764261.
- ^ Maugh, T. (1979). “Panel urges wide use of antiviral drug”. Science 206 (4422): 1058. doi:10.1126/science.386515. PMID 386515.
- ^ Sonnberg, Lynn (2003). The Complete Pill Guide: Everything You Need to Know about Generic and Brand-Name Prescription Drugs. Barnes & Noble Publishing. p. 87. ISBN 0-7607-4208-1
- ^ Blanpied, T. A.; Clarke, R. J.; Johnson, J. W. (2005). “Amantadine inhibits NMDA receptors by accelerating channel closure during channel block”. Journal of Neuroscience 25 (13): 3312-3322. doi:10.1523/JNEUROSCI.4262-04.2005. PMID 15800186.
- ^ US patented 5880154, Boukrinskaia, Alissa G. et al., "Polymeric adamantane derivatives", issued 1999-03-09, assigned to The Board of Regents of the University of Nebraska
- ^ “Adamantane” (Russian). Krugosvet. 2009年11月6日時点のオリジナルよりアーカイブ。2009年11月11日閲覧。
- ^ Jeong, H. Y. et al. (2002). “Synthesis and characterization of the first adamantane-based poly(p-phenylenevinylene) derivative: an intelligent plastic for smart electronic displays”. Thin Solid Films 417 (1-2): 171-174. doi:10.1016/S0040-6090(02)00569-2.
- ^ Ramezani, Hamid; Mansoori, G. Ali (2007). “Diamondoids as Molecular Building Blocks for Nanotechnology”. Topics in Applied Physics 109 (Molecular Building Blocks for Nanotechnology): 44-71. doi:10.1007/978-0-387-39938-6_4.
- ^ N-ヘテロ環状カルベン / N-Heterocyclic Carbene (NHC)、化学者のつぶやき―chem-station、2009年10月27日
- ^ Vitall, J. J. (1996). “The Chemistry of Inorganic and Organometallic Compounds with Adamantane-Like Structures”. Polyhedron 15 (10): 1585-1642. doi:10.1016/0277-5387(95)00340-1.
- ^ Fischer, Jelena; Baumgartner, Judith; Marschner, Christoph (2005). “Synthesis and Structure of Sila-Adamantane”. Science 310 (5749): 825. doi:10.1126/science.1118981. PMID 16272116.
- ^ Mancini, Ines; Guella, Graziano; Frostin, Maryvonne; Hnawia, Edouard; Laurent, Dominique; Debitus, Cecile; Pietra, Francesco (2006). “On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine SpongeEchinochalina bargibanti”. Chemistry - A European Journal 12 (35): 8989–94. doi:10.1002/chem.200600783. PMID 17039560.
関連項目[編集]
- ツイスタン - プリズマン
- アマンタジン - メマンチン - ビルダグリプチン
- 1-アダマンタノール - 2-アダマンタノール - 1,3-アダマンタンジオール - 2-アダマンタノン
- ヘキサメチレンテトラミン
外部リンク[編集]
- 征服されざるもの・アダマンタン - 有機化学美術館
- 小さなダイヤモンド・アダマンタン - 同上
- アダマンタン - 結晶美術館