自然免疫系

自然免疫系(しぜんめんえきけい、innate immune system)または非特異的免疫系(ひとくいてきめんえきけい、nonspecific immune system)[1]は、脊椎動物における2つの主要な免疫戦略の1つである(もう1つは獲得免疫系)。自然免疫系は、比較的古い進化を遂げた防御戦略であり、植物、菌類、昆虫、および原始的な多細胞生物に見られる支配的な免疫系反応である[2]。
自然免疫系の主な機能は以下の通りである。
- サイトカインと呼ばれるケミカルメディエーターを含む化学的因子を産生することにより、感染部位に免疫細胞を呼び込む
- 補体カスケードを活性化して細菌を識別し、細胞を活性化し、免疫複合体や死細胞の除去を促進する
- 臓器、組織、血液、リンパなどに存在する異物を、特殊な白血球によって識別、除去する
- 抗原提示により獲得免疫系を活性化する
- 第一次の物理的バリア(既に宿主に侵入した病原体から神経系を保護する血液脳関門などの第二次の物理的・化学的バリアと混同してはならない)を突破した挫傷などの傷害後に放出される皮膚などの物理的手段や血液中の凝固因子などの化学的手段を介して、感染物質に対する物理的・化学的バリアとして機能する
解剖学的障壁[編集]
解剖学的バリアには、物理的、化学的、生物学的バリアがある。上皮表面は、ほとんどの感染性物質に対して不透過性の物理的バリアを形成し、侵入生物に対する最初の防御線として機能する[3]。また、皮膚上皮の落屑(脱落)は、上皮表面に付着した細菌やその他の感染性物質を除去するのに役立つ。血管がないこと、表皮が水分を保持できないこと、真皮に皮脂腺があることなどから、微生物の生存には適していない環境である[3]。消化管や呼吸器では、それぞれ蠕動や繊毛による動きが感染物質の除去に役立っている[3]。また、粘液は感染物質を閉じ込める働きがある[3]。腸内細菌叢は、有害物質を分泌したり、栄養分や細胞表面の付着場所を巡って病原菌と競合することで、病原菌の定着を防ぐ[3]。涙や唾液の洗浄作用は、目や口の中の感染を防ぐのに役立つ[3]。
| 解剖学的バリア | 追加防御機構 |
|---|---|
| 皮膚 | 発汗、落屑、紅潮[3]、有機酸[3] |
| 消化管 | 蠕動運動、胃酸、胆汁酸、消化酵素、紅潮、 |
| 気道および肺 | 粘膜毛様体輸送[4]、界面活性剤[3]、ディフェンシン[3] |
| 鼻咽頭 | 粘液、唾液、リゾチーム[3] |
| 眼 | 涙[3] |
| 血液脳関門 | 内皮細胞(受動的拡散/浸透/能動的選択を経由) |
炎症[編集]
炎症は、感染や刺激に対する免疫系の最初の反応の一つである。炎症は、損傷を受けた細胞から放出される化学因子によって刺激される。炎症は、感染の拡大に対する物理的バリアを確立し、病原体の除去後に損傷した組織の治癒を促進する[5]。
急性炎症のプロセスは、すべての組織にすでに存在する細胞、主に常駐するマクロファージ、樹状細胞、組織球、クッパー細胞、肥満細胞によって開始される。これらの細胞は、パターン認識受容体(PRR)と呼ばれる細胞表面や細胞内に含まれる受容体を提示し、病原体に広く共通するが宿主の分子とは区別される分子(病原体関連分子パターン;PAMP)を認識する。感染症や火傷などの受傷時に、これらの細胞は活性化され(PRRの1つがPAMPを認識)、炎症の臨床症状を引き起こす炎症性メディエーターを放出する。
炎症時に産生される化学因子(ヒスタミン、ブラジキニン、セロトニン、ロイコトリエン、プロスタグランジン)は、侵害受容器を感作し、血管の局所的な拡張を引き起こし、食細胞、特に好中球を引き寄せる[5]。好中球は、白血球やリンパ球を呼び寄せる因子を放出して、免疫系の他の部分を刺激する。マクロファージや自然免疫系の他の細胞が産生するサイトカインは、炎症反応を媒介する。これらのサイトカインには、TNF、HMGB1、IL-1などがある[6]。
炎症反応の特徴として、以下のような症状が挙げられる。
- 局所的な血液循環の増加による皮膚の発赤
- 局所的な感染症の周囲の温感などの局所的な温度上昇、または全身的な発熱
- 患部の腫れ(風邪をひいたときの喉の上部や、関節リウマチの関節など)
- 鼻水や咳などの症状の原因となる粘液の分泌量の増加
- 関節痛や喉の痛みなどの局所的な痛み、あるいは筋肉痛などの全身的な痛み
- 関係する臓器や組織の機能障害の可能性
補体系[編集]
補体系は免疫系の生化学的カスケードであり、抗体が病原体を排除したり、他の細胞による破壊の目印となったりする能力を助ける、つまり「補う」ものである。このカスケードは、多くの血漿タンパク質で構成されており、主に肝臓で肝細胞により合成される。これらのタンパク質は、以下のような働きをする。
- 炎症細胞を動員する
- 病原体の表面をオプソニン化(コーティング)することにより、他の細胞による破壊のために病原体を「標識」する
- 病原体の細胞膜に穴を開け、病原体の細胞を溶かし、病原体を死滅させる
- 中和された抗原抗体複合体を体外に排出する
補体系には、古典的経路、副経路、レクチン経路の3種類がある。
補体カスケードの要素は、植物、鳥類、魚類、無脊椎動物の一部など、哺乳類以外の多くの種に見られる[7]。
白血球[編集]

白血球の多くは、他の細胞と異なり、特定の器官や組織と密接に結びついていないため、その機能は独立した単一細胞の生物に似ている。ほとんどの白血球は自由に動き回ることができ、細胞の破片や異物、侵入してきた微生物と相互作用して捕らえることができる(ただし、マクロファージ、肥満細胞、樹状細胞は動きがたい)。他の多くの細胞とは異なり、ほとんどの自然免疫系白血球は、自ら分裂したり繁殖したりすることはできず、骨髄に存在する多能性造血幹細胞から産生される[8]。
自然免疫系白血球には、ナチュラルキラー細胞、肥満細胞、好酸球、好塩基球が含まれ、食細胞にはマクロファージ、好中球、樹状細胞などがあり、免疫システムの中で、感染症を引き起こす可能性のある病原体を特定して排除する機能を持っている[2]。
肥満細胞[編集]
肥満細胞は、結合組織や粘膜に存在する自然免疫細胞の一種である。肥満細胞は、創傷治癒や病原体に対する防御に深く関わっているが、アレルギーやアナフィラキシーにもしばしば関与している[5]。活性化すると、肥満細胞はヒスタミンやヘパリンを豊富に含む特徴的な顆粒を、さまざまなホルモンメディエーターやケモカイン(走化性サイトカイン)と共に環境中に速やかに放出する。ヒスタミンは血管を拡張し、炎症の特徴的な兆候を引き起こし、好中球やマクロファージを呼び寄せる[5]。
食細胞[編集]
食細胞とは、文字通り「食べる細胞」という意味である。食細胞は、病原体や粒子を呑み込む(食作用)免疫細胞である。粒子や病原体を取り込むために、食細胞は細胞膜の一部を拡張し、粒子が包み込まれる(粒子が細胞内に入る)まで、膜を粒子の周りに巻きつけます。細胞内に侵入した病原体は、ファゴソームの中に収められ、リソソームと合流する[2]。リソソームには、粒子や生物を殺したり消化したりする酵素や酸が含まれている。一般的に、食細胞は病原体を探して体内を巡回するが、サイトカインと呼ばれる他の細胞が作り出す高度に専門化された分子シグナル群に反応することもできる。免疫系の食細胞には、マクロファージ、好中球、樹状細胞などがある。
宿主自身の細胞を貪食することは、通常の組織の発達と維持の一環としてよく行われる。宿主の細胞がアポトーシスや感染による細胞傷害によって死滅した場合、食細胞はその細胞を患部から除去する役割を果たす[8]。死んだ細胞を除去することで、新しい健康な細胞の成長と発達を促進するファゴサイトーシスは、組織の損傷後の治癒プロセスにおいて重要な役割を果たしている。
マクロファージ[編集]

マクロファージは、ギリシャ語で「大きな食べる人」を意味する言葉で、大型の食細胞性白血球であり、侵入してきた病原体を追って毛細血管の壁を移動し、細胞間の領域に入り込むことで、血管系を超えて移動することができる。組織では、臓器特異的なマクロファージは、単球と呼ばれる血液中に存在する食細胞から分化している。マクロファージは最も効率的な食細胞であり、相当数の細菌や他の細胞、微生物を貪食することができる[2]。マクロファージの表面にある受容体に細菌の分子が結合すると、マクロファージは呼吸バーストを発生させ、活性酸素種の放出を引き起こして細菌を呑み込み、破壊する。病原体はまた、マクロファージを刺激してケモカインを産生させ、他の細胞を感染部位に呼び寄せる[2]。
好中球[編集]
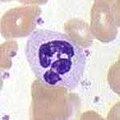
好中球は、好酸球や好塩基球と共に、細胞質に顆粒が存在することから顆粒球と呼ばれ、特徴的な小葉状の核があることから多形核細胞(PMN)と呼ばれる。好中球の顆粒には、細菌や真菌を死滅させたり、増殖を抑制したりするさまざまな毒性物質が含まれている。マクロファージと同様に、好中球は呼吸バーストを発生させて病原体を攻撃する。好中球の呼吸バーストの主な生成物は、過酸化水素、フリーオキシドラジカル、次亜塩素酸などの強力な酸化剤である。好中球は最も多く存在する食細胞で、通常、循環する白血球全体の50~60%を占め、通常、感染部位に最初に到着する細胞である[5]。健康な成人の骨髄では、1日に1,000億個以上の好中球が産生され、急性炎症時にはその10倍以上の好中球が産生される[5]。
樹状細胞[編集]
樹状細胞(DC)は、主に皮膚(ランゲルハンス細胞と呼ばれることが多い)や、鼻、肺、胃、腸などの粘膜内部など、外部環境と接触する組織に存在する食作用を持つ細胞である[8]。神経細胞の樹状突起に似ていることから名付けられたが、樹状細胞は神経系とは無関係である。樹状細胞は、抗原提示の過程で非常に重要であり、自然免疫系と獲得免疫系をつなぐ役割を果たしている。
好塩基球および好酸球[編集]

好塩基球と好酸球は、好中球に関連する細胞である。病原体に遭遇して活性化されると、ヒスタミンを放出する好塩基球は、寄生虫に対する防御に重要な役割を果たすと共に、喘息などのアレルギー反応にも関与する[2]。活性化された好酸球は、さまざまな毒性の高いタンパク質やフリーラジカルを分泌し、寄生虫を殺すのに非常に有効であるが、アレルギー反応の際に組織を損傷することもある。したがって、好酸球による毒素の活性化と放出は、不適切な組織破壊を防ぐために厳密に制御されている[5]。
ナチュラルキラー細胞[編集]
ナチュラルキラー細胞(NK細胞)は、侵入してきた微生物を直接攻撃するのではない。NK細胞は、腫瘍細胞やウイルスに感染した細胞など、危害を加えられた宿主細胞を破壊するが、その際、「自己喪失」と呼ばれる状態の細胞を認識する。これは、MHC I(主要組織適合性複合体)と呼ばれる細胞表面のマーカーが異常に少なくなった細胞のことで、ウイルスが宿主細胞に感染した場合に生じることがある[9]。この細胞は、「自己を失った」細胞を殺すために活性化を必要としないという当初の考え方から、「ナチュラルキラー」と名付けられた。傷ついた細胞の表面にあるMHCの構造が変化し、それを認識してNK細胞が活性化する。正常な体細胞は、自己のMHC抗原がそのまま発現しているので、NK細胞に認識されて攻撃されることはない。このMHC抗原はキラー細胞免疫グロブリン様受容体(KIR)に認識され、NK細胞の反応を鈍らせます。NK-92細胞株はKIRを発現しておらず、腫瘍治療用に開発されたものである[10][11][12][13]。
γδT細胞[編集]
γδT細胞は、CD1d拘束性ナチュラルキラーT細胞など、不変のT細胞受容体(TCR)を持つが「型破り」な他のT細胞サブセットと同様に、自然免疫と獲得免疫の境界に位置する特徴を持つ。γδT細胞は、TCR遺伝子を再構成して結合部の多様性を生み出し、記憶表現型を発現するという点で、獲得免疫の構成要素と考えられる。また、さまざまなサブセットは、制限されたTCRやNK受容体がパターン認識受容体として使用される自然免疫系の一部と考えられる。例えば、このパラダイムによれば、大量のVγ9/Vδ2 T細胞は微生物が産生する一般的な分子に数時間以内に反応し、高度に制限された上皮内Vδ1 T細胞はストレスを受けた上皮細胞に反応する。
他の脊椎動物でのメカニズム[編集]
凝固系の機能は免疫系と一部重なっている。凝固系の産物の中には、血管透過性を高めたり、食細胞の走化性物質として作用したりすることで、非特異的な防御に寄与するものがある。さらに、凝固系の産物の中には、直接抗菌作用を持つものもある。例えば、凝固時に血小板で生成されるタンパク質であるβ-リジンは、陽イオン性の洗剤として作用することにより、多くのグラム陽性菌を溶解させられる[3]。炎症の急性期タンパク質の多くは、凝固系に関与している。
オートファジーは、真核細胞が微生物[14]から身を守り、炎症を調節するもう一つの自然免疫機構[15][16]である[17]。
ラクトフェリンやトランスフェリンが増加すると、細菌の必須栄養素である鉄と結合して細菌の増殖を抑制する[3]。
神経調節[編集]
感染性および無菌性の傷害に対する自然免疫反応は、サイトカイン産生期間を制御する神経回路によって調節される。炎症反射は、脾臓でのサイトカイン産生を制御する典型的な神経回路である[18]。迷走神経を介して脾臓に伝わる活動電位は、サイトカイン産生細胞に発現するα7ニコチン性アセチルコリン受容体(CHRNA7)と相互作用することで、サイトカインの放出を抑制する神経伝達物質であるアセチルコリンの放出を媒介する[19]。炎症反射の運動弓は、コリン性抗炎症経路と呼ばれている。
病原体特異性[編集]
自然免疫系の各部分は、異なる病原体に対して特異性を示す。
| 病原体 | 実例[20] | 食作用[20] | 補体[20] | NK細胞[20] |
|---|---|---|---|---|
| 細胞内・細胞質顆粒 ウイルス |
yes | yes[21] | yes | |
| 細胞内細菌 | yes (特に好中球。リケッチアはno) | yes[22] | yes (リケッチアはno) | |
| 細胞外細菌 | yes | yes | no | |
| 細胞内原生動物 | no | no | no | |
| 細胞外原生動物 | yes | yes | no | |
| 細胞外真菌 | no | yes | yes[23] |
免疫回避[編集]
自然免疫系細胞は体内での微生物の自由な増殖を防ぐが、多くの病原体はそれを回避するためのメカニズムを進化させている[24][25]。
その一つが、結核菌のように細胞内で複製を行う方法や、サルモネラ菌のように保護カプセルを装着して補体や食細胞による溶解を防ぐ方法である[26]。バクテロイデス属は通常、相利共生細菌であり、哺乳類の胃腸内細菌叢のかなりの部分を占めている[27]。B. fragilisのような種は日和見病原体であり、腹膜腔の感染症を引き起こす。B. fragilis は、細菌の取り込みに使用される食細胞の受容体に影響を与え、食作用を阻害する。また、宿主の細胞に擬態して、免疫系が異物として認識しないようにすることもある。黄色ブドウ球菌は、食細胞がケモカインシグナルに反応する能力を阻害する。結核菌、化膿レンサ球菌、炭疽菌は、食細胞を直接死滅させるメカニズムを持っている[要出典]。
細菌や真菌は複雑な菌膜を形成し、免疫細胞やタンパク質から身を守ることがある。嚢胞性線維症に特徴的な緑膿菌やBurkholderia cenocepaciaの慢性感染症には菌膜が存在する[28]。
ウイルス[編集]
I型インターフェロン(IFN)は、主に樹状細胞から分泌され[29]、抗ウイルス性の宿主防御や細胞の抗ウイルス過程に中心的な役割を果たしている[30]。ウイルスの成分は、さまざまな受容体によって認識される。Toll様受容体はエンドソーム膜に存在して二本鎖RNA(dsRNA)を認識し、MDA5受容体とRIG-I受容体は細胞質に存在してそれぞれ長いdsRNAとリン酸を含むdsRNAを認識する[31]。細胞質の受容体MDA5とRIG-Iがウイルスを認識すると、カスパーゼ動員ドメイン(CARD)とCARDを含むアダプターMAVSの間の構造が変化する。これと並行して、エンドサイト部に存在するTLRがウイルスを認識すると、アダプタータンパク質TRIFの活性化が誘導される。この2つの経路は、IKKε/TBK-1複合体のリクルートと活性化に収束し、転写因子IRF3とIRF7の二量体化を誘発する。IRF3とIRF7は核内に移動し、特定の転写因子の存在によりIFNの産生を誘導し、転写因子2を活性化する。IFNは、分泌小胞を介して分泌され、放出された細胞自身(自己分泌)と近くの細胞(傍分泌)の両方の受容体を活性化することができる。これにより、何百ものインターフェロン刺激遺伝子の発現が誘導される。これにより、ウイルスのタンパク質合成を阻害するプロテインキナーゼRや、ウイルスのRNAを分解する2′,5′-オリゴアデニル酸合成酵素ファミリーなどの抗ウイルスタンパク質が産生される[30]。
ウイルスの中には、IFNの産生を妨害する分子を産生することでこれを回避するものもある。例えば、A型インフルエンザウイルスは、NS1タンパク質を産生する。NS1タンパク質は、宿主やウイルスのRNAに結合したり、免疫シグナルタンパク質と相互作用したり、ユビキチン化によってその活性化を阻害したりして、I型IFNの産生を阻害する[32]。また、インフルエンザAは、プロテインキナーゼRの活性化を阻害し、抗ウイルス過程の確立を阻害する[33]。デングウイルスも、NS2B3プロテアーゼ複合体を用いてIRF3のリン酸化を阻害することで、I型IFNの産生を抑制する[34]。
脊椎動物以外[編集]
原核生物[編集]
バクテリア(およびおそらく他の原核生物)は、バクテリオファージなどの病原体から身を守るために、制限修飾系と呼ばれる独自の防御機構を利用している。このシステムでは、バクテリアは制限酵素と呼ばれる酵素を産生し、侵入してきたバクテリオファージのウイルスDNAの特定領域を攻撃して破壊する。宿主自身のDNAをメチル化することで、「自己」であることを示し、エンドヌクレアーゼによる攻撃を防ぐことができる[35]。制限酵素と制限修飾系は、原核生物にのみ存在する[36]。
無脊椎動物[編集]
無脊椎動物は、リンパ球や抗体ベースの体液性免疫系を持たず、多成分の獲得免疫系は最初の脊椎動物から生まれたと考えられている[37]。しかし、無脊椎動物は、脊椎動物の免疫系の前駆体と思われるメカニズムを持っている。パターン認識受容体(PRR)は、ほぼすべての生物が微生物の病原体に関連する分子を識別するために使用するタンパク質である。Toll様受容体はパターン認識受容体の代表的なもので、ヒトを含むすべての体腔動物に存在する[38]。補体系はほとんどの生命体に存在する。昆虫、カニ、ミミズなどの無脊椎動物の中には、フェノール酸化酵素前駆体(proPO)系として知られる補体反応の改良型が存在する[37]。
抗微生物ペプチドは、進化的に保存された自然免疫反応の構成要素であり、無脊椎動物の全身性免疫の主要な形態である。昆虫の中には、ディフェンシンやセクロピンと呼ばれる抗菌ペプチドを産生する種がある。
タンパク質分解カスケード[編集]
無脊椎動物では、PRRはタンパク質を分解するタンパク質分解カスケードを引き起こし、無脊椎動物の自然免疫系のメカニズムの多くを制御している(血リンパ凝固やメラニン化など)。タンパク質分解カスケードは遺伝子の変化に依存せず、他の自然免疫反応に比べてより迅速にオンになるため、無脊椎動物の免疫システムの重要な構成要素となっている。タンパク質分解カスケードは、脊椎動物と無脊椎動物の両方で機能するが、カスケード全体で使用されるタンパク質は異なる[39]。
凝固機構[編集]
節足動物の循環系の液体を構成する血リンパでは、他の動物の血液と同様に、ゲル状の液体が侵入した病原体を取り囲む。無脊椎動物の血液凝固には、さまざまなタンパク質やメカニズムが関与している。甲殻類では、血球由来のグルタミン転移酵素と移動性の血漿タンパク質が凝固系を構成しており、グルタミン転移酵素が血漿凝固タンパク質の210kDaのサブユニットが多量体化する。一方、カブトガニの血液凝固系では、タンパク質分解カスケードの構成要素は不活性型として血球の顆粒に貯蔵されており、リポ多糖のような異物が侵入すると放出される[39]。
植物[編集]
人間に感染するあらゆる種類の病原体が、植物にも感染する。細菌、真菌、ウイルス、線虫、昆虫など、感染する生物種によって病原体の種類は異なるが、いずれも植物の病気を引き起こす可能性がある。動物と同様に、昆虫や他の病原体に襲われた植物は、一連の複雑な代謝反応を利用して感染に対抗したり、昆虫や他の草食動物にとって魅力のない植物にするための防御的な化学物質を形成する[40]。(参照:草食動物に対する植物の防御)。
無脊椎動物のように、植物は抗体やT細胞の反応を起こさず、病原体を検出して攻撃する移動細胞も持っていない。また植物の場合、感染症になった場合、その一部を使い捨てて、交換可能なものとして扱うことがある。動物ではこの機能はまずない。植物体はその一部を壁で囲ったり、廃棄したりすることで、感染の拡大を防ぐ[40]。
植物の免疫反応の多くは、植物全体に送られる全身性の化学シグナルを伴う。植物はPRRを使って、保存された微生物のサインを認識する。この認識が免疫反応の引き金となる。イネ(XA21、1995年)[41][42]やシロイヌナズナ(FLS2、2000年)[43]では、保存された微生物特異配列[注 1]を認識する最初の植物受容体が同定された。また、植物は病原体のエフェクターを認識する免疫受容体を持っている。その中には、NBS-LRRクラスのタンパク質も含まれている。植物の一部が微生物やウイルス性の病原体に感染して特異的な生体防御反応誘導物質によって不適合な相互作用が引き起こされた場合、植物は局所的な過敏感反応(HR)を起こし、感染部位の細胞が急速にアポトーシスを起こして、植物の他の部位への病原体の拡散を防ぐ。HRは動物のピロトーシスと類似しており、細胞死の際に細胞の分解を制御するシステインプロテアーゼであるVPEγのカスパーゼ-1様プロテアーゼ活性が必要であることなどが知られている[44]。
抵抗性(R)遺伝子によってコードされるRタンパク質は、植物に広く存在し、病原体を検出する。これらのタンパク質には、NOD様受容体やTLRに類似したドメインが含まれている。全身獲得抵抗性(SAR)とは、植物全体が広範囲の感染性物質に対して抵抗性を示す防御反応の一種である[45]。SARでは、サリチル酸やジャスモン酸などの化学伝達物質を生成し、その一部が植物体内を移動して他の細胞にシグナルを送り、感染していない部分(例えば葉)を守るための防御物質を生成する[46]。サリチル酸自体はSARの発現に不可欠ではあるが、全身性の反応を引き起こす移動性のシグナルではない。最近の研究では、ジャスモン酸が植物の遠位部へのシグナル伝達に関与していることが示唆されている。RNAサイレンシング機構は、ウイルスの複製を阻止することができるため、植物の全身性反応において重要である[47]。ジャスモン酸反応は、昆虫によってダメージを受けた葉で刺激され、ジャスモン酸メチルを生成する[40]。
関連項目[編集]
脚注[編集]
注釈[編集]
- ^ Conserved Signature Indels(CSIs、核酸塩基配列)と Conserved Signature Proteins(CSPs、アミノ酸配列)を指す。ここでは、Indels = Insert & Deletion。
出典[編集]
- ^ “Immune response: MedlinePlus Medical Encyclopedia” (英語). medlineplus.gov. 2021年11月7日閲覧。
- ^ a b c d e f Immunobiology (Fifth ed.). New York and London: Garland Science. (2001). ISBN 0-8153-4101-6.
- ^ a b c d e f g h i j k l m n o p q “Innate (Non-Specific) Immunity”. Immunology Section of Microbiology and Immunology On-line.. University of South Carolina. 2021年11月19日閲覧。
- ^ “Mucociliary escalator.”. Saunders Comprehensive Veterinary Dictionary. Elsevier, Inc. (2007年). 2018年6月11日閲覧。
- ^ a b c d e f g “Inflammation and Fever”. Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. (1995). オリジナルの18 June 2007時点におけるアーカイブ。
- ^ “High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal”. Nature Reviews. Immunology 5 (4): 331–342. (April 2005). doi:10.1038/nri1594. PMID 15803152.
- ^ Immunobiology. (6th ed.). Garland Science. (2005). ISBN 0-443-07310-4
- ^ a b c Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. (2002). ISBN 0-8153-3218-1
- ^ Immunobiology (6th ed.). Garland Science. (2005). ISBN 0-443-07310-4
- ^ “Infusion of the allogeneic cell line NK-92 in patients with advanced renal cell cancer or melanoma: a phase I trial”. Cytotherapy 10 (6): 625–632. (2008). doi:10.1080/14653240802301872. PMID 18836917.
- ^ “Cellular immunotherapy of malignancies using the clonal natural killer cell line NK-92”. Journal of Hematotherapy & Stem Cell Research 10 (4): 535–544. (August 2001). doi:10.1089/15258160152509145. PMID 11522236.
- ^ “Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells”. Leukemia 8 (4): 652–658. (April 1994). PMID 8152260.
- ^ “Development and testing of NK cell lines”. Natural killer cells - Basic Science and Clinical applications. (2010). pp. 169–75
- ^ “Eating oneself and uninvited guests: autophagy-related pathways in cellular defense”. Cell 120 (2): 159–162. (January 2005). doi:10.1016/j.cell.2005.01.005. PMID 15680321.
- ^ “Unveiling the roles of autophagy in innate and adaptive immunity”. Nature Reviews. Immunology 7 (10): 767–777. (October 2007). doi:10.1038/nri2161. PMC 7097190. PMID 17767194.
- ^ “Autophagy in inflammation, infection, and immunometabolism”. Immunity 54 (3): 437–453. (March 2021). doi:10.1016/j.immuni.2021.01.018. PMC 8026106. PMID 33691134.
- ^ “Autophagy in infection, inflammation and immunity”. Nature Reviews. Immunology 13 (10): 722–737. (October 2013). doi:10.1038/nri3532. PMC 5340150. PMID 24064518.
- ^ “Physiology and immunology of the cholinergic antiinflammatory pathway”. The Journal of Clinical Investigation 117 (2): 289–296. (February 2007). doi:10.1172/JCI30555. PMC 1783813. PMID 17273548.
- ^ “Reflex control of immunity”. Nature Reviews. Immunology 9 (6): 418–428. (June 2009). doi:10.1038/nri2566. PMC 4535331. PMID 19461672.
- ^ a b c d Immunology. Lippincott Williams & Wilkins. (2008). p. 172. ISBN 978-0-7817-9543-2
- ^ “Complement Evasion Strategies of Viruses: An Overview”. Frontiers in Microbiology 8: 1117. (2017-06-16). doi:10.3389/fmicb.2017.01117. PMC 5472698. PMID 28670306.
- ^ “Activation of the human complement alternative pathway by Listeria monocytogenes: evidence for direct binding and proteolysis of the C3 component on bacteria”. Infection and Immunity 61 (12): 5134–5139. (December 1993). doi:10.1128/iai.61.12.5134-5139.1993. PMC 281293. PMID 8225590.
- ^ “NK cells use perforin rather than granulysin for anticryptococcal activity”. Journal of Immunology 173 (5): 3357–3365. (September 2004). doi:10.4049/jimmunol.173.5.3357. PMID 15322199.
- ^ “Immune Evasion by bacteria”. Crohnie. 2021年11月19日閲覧。
- ^ “Anti-immunology: evasion of the host immune system by bacterial and viral pathogens”. Cell 124 (4): 767–782. (February 2006). doi:10.1016/j.cell.2006.01.034. PMID 16497587.
- ^ “Common themes in microbial pathogenicity revisited”. Microbiology and Molecular Biology Reviews 61 (2): 136–169. (June 1997). doi:10.1128/.61.2.136-169.1997. PMC 232605. PMID 9184008.
- ^ Dorland's Illustrated Medical Dictionary (30th ed.). W.B. Saunders. (2003). ISBN 0-7216-0146-4
- ^ “Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections”. Treatments in Respiratory Medicine 4 (4): 241–253. (2005). doi:10.2165/00151829-200504040-00003. PMID 16086598.
- ^ “Links between innate and adaptive immunity via type I interferon”. Current Opinion in Immunology 14 (4): 432–436. (August 2002). doi:10.1016/s0952-7915(02)00354-0. PMID 12088676.
- ^ a b “Pathogen recognition and innate immunity”. Cell 124 (4): 783–801. (February 2006). doi:10.1016/j.cell.2006.02.015. PMID 16497588.
- ^ “Induction of type I interferon by RNA viruses: cellular receptors and their substrates”. Amino Acids 38 (5): 1283–1299. (May 2010). doi:10.1007/s00726-009-0374-0. PMC 2860555. PMID 19882216.
- ^ “Ubiquitin in the activation and attenuation of innate antiviral immunity”. The Journal of Experimental Medicine 213 (1): 1–13. (January 2016). doi:10.1084/jem.20151531. PMC 4710203. PMID 26712804.
- ^ “Influenza A virus lacking the NS1 gene replicates in interferon-deficient systems”. Virology 252 (2): 324–330. (December 1998). doi:10.1006/viro.1998.9508. PMID 9878611.
- ^ “Inhibition of the type I interferon response in human dendritic cells by dengue virus infection requires a catalytically active NS2B3 complex”. Journal of Virology 84 (19): 9760–9774. (October 2010). doi:10.1128/jvi.01051-10. PMC 2937777. PMID 20660196.
- ^ “Restriction Enzymes”. Access Excellence Classic Collection Background Paper. 2021年11月19日閲覧。
- ^ “The interplay of restriction-modification systems with mobile genetic elements and their prokaryotic hosts”. Nucleic Acids Research 42 (16): 10618–10631. (2014). doi:10.1093/nar/gku734. PMC 4176335. PMID 25120263.
- ^ a b “Immunity and the invertebrates”. Scientific American 275 (5): 60–3, 66. (November 1996). Bibcode: 1996SciAm.275e..60B. doi:10.1038/scientificamerican1196-60. PMID 8875808.
- ^ “Toll receptors in innate immunity”. Trends in Cell Biology 11 (7): 304–311. (July 2001). doi:10.1016/S0962-8924(01)02004-9. PMID 11413042.
- ^ a b “Proteolytic cascades and their involvement in invertebrate immunity”. Trends in Biochemical Sciences 35 (10): 575–583. (October 2010). doi:10.1016/j.tibs.2010.04.006. PMID 20541942.
- ^ a b c “Plant immune responses”. Stanford University Department of Microbiology and Immunology (2005年). 2007年6月9日時点の[ijio[joij[oi[oimiohuh79-9yrse.html オリジナルよりアーカイブ。
- ^ “A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21”. Science 270 (5243): 1804–1806. (December 1995). Bibcode: 1995Sci...270.1804S. doi:10.1126/science.270.5243.1804. PMID 8525370.
- ^ “Plant and animal sensors of conserved microbial signatures”. Science 330 (6007): 1061–1064. (November 2010). Bibcode: 2010Sci...330.1061R. doi:10.1126/science.1189468. PMID 21097929.
- ^ “FLS2: an LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis”. Molecular Cell 5 (6): 1003–1011. (June 2000). doi:10.1016/S1097-2765(00)80265-8. PMID 10911994.
- ^ “VPEgamma exhibits a caspase-like activity that contributes to defense against pathogens”. Current Biology 14 (21): 1897–1906. (November 2004). doi:10.1016/j.cub.2004.09.056. PMID 15530390.
- ^ Chitosan#Agricultural .26 Horticultural use
- ^ “Organic disease control elicitors.”. Agro Food Industry Hi-Tech 11 (5): 32–4. (2000). オリジナルの6 July 2007時点におけるアーカイブ。.
- ^ “RNA silencing in plants”. Nature 431 (7006): 356–363. (September 2004). Bibcode: 2004Natur.431..356B. doi:10.1038/nature02874. PMID 15372043.
外部リンク[編集]
- “InnateDB”. 2021年11月19日閲覧。 “database of proteins and their interactions in innate immune system”
