振動準位
振動準位(しんどうじゅんい)は分子の重心の移動を伴わず、核の相対的な位置の変位にともなう運動を表す量子状態である。分子内において核は、結合する隣接核と結合エネルギーに相当するポテンシャルの井戸を形成し、お互いばねで結ばれた様な状態にあるために、上記のような運動は振動運動によって記述される(詳細は以下の章を参照)。振動準位間の遷移は振動遷移(しんどうせんい)と呼ばれ、主に赤外分光法またはラマン分光法によって観測される。
二原子分子の調和振動[編集]
古典論[編集]

二原子分子において2つの原子核の運動をばねによって結ばれた2つの粒子の調和振動子で近似する。2つの原子核が一直線上の位置 x1, x2 にあるとすると、フックの法則からそれぞれの核にはたらく力は
x はばねの変位(l0をばねに伸び縮みが無いときの長さとしたとき x = x2 − x1 − l0)、k はばね定数を表す。マイナス符号は、2つの核に反対向きの力が働くことを示す。
ここで換算質量を導入し、2つの核の相対運動を一方を固定した1つの粒子の運動で表す。 はじめの式を m1、2つ目の式を m2 で割り、2式を引いて整理すると
この運動のポテンシャルエネルギー U の位置についての微分は、粒子に働く力に負を乗じたものであるから、
これを積分するとポテンシャルエネルギーが得られる(ただし積分定数が0となるようにポテンシャルエネルギーの基準点をとった)。
これは伸び縮みのない状態を極小とした、二次関数である。分子のなかで核のまわりのポテンシャルは、極小点(平衡核間距離近傍)においては二次関数と近似できるので、調和振動子近似は、分子における核の相対運動を近似できると考えられる。 全エネルギー(ハミルトニアン)はこのポテンシャルエネルギーに運動エネルギーを加えたものであるから、次のように書ける。
量子論[編集]
古典論から量子論に移るには、古典論のハミルトニアンに含まれる位置xを位置演算子に、運動量pを運動量演算子に置き換えればよい(正準量子化)。
この量子的なハミルトニアンの固有値問題を解くと、固有エネルギーは次のように得られる。
ただし。ここでn は振動の量子数と呼ばれる。分子振動を調和振動で近似すると、その量子的なエネルギーはn について等間隔なエネルギー準位となる。
振動遷移の選択律[編集]
量子論[編集]
量子力学における摂動論を用いて対称性を考えると、以下の様な選択律が得られる。
赤外吸収による遷移[編集]
- 振動量子数の変位
- 振動による双極子の変位が0で無い
赤外吸収により振動遷移が起こるためには、振動による双極子の変位が0で無いことが必要である。つまり、
ラマン効果による遷移[編集]
- 振動量子数の変位
- 振動による分極率の変化が0でない
ここでは分極率、Qjはj番目の基準座標
群論[編集]
量子論から導かれる選択律は厳密なものであるが、群論の知識を使えば、より簡単に遷移が起きる振動を知ることができる。
まず適切な基底を導入し、振動をあらわす表現行列を作る。これは一般には可約表現の表現行列である。基底の選び方によっては、振動運動以外にも並進運動や回転運動も含まれている場合があり、これらは取り除く。表現行列の指標表を分子の対称性を表す点群の指標表を用いて既約表現へ分解する。
赤外吸収[編集]
既約表現の指標表を見て、遷移モーメントがその点群において属する既約表現と同じであれば赤外光を吸収する。つまり指標表のx、y、zが属する既約表現と同じであれば、その既約表現で表される振動は赤外線を吸収する。
ラマン効果[編集]
既約表現の指標表を見て、分極率がその点群において属する既約表現と同じであればラマン効果が起きる。つまり指標表のx2、y2、z2、xy、yz、zxの一つもしくはx2-y2が属する既約表現と同じであれば、その既約表現で表される振動はラマン効果が起きる。
調和振動ポテンシャルと実際の分子のポテンシャル[編集]
調和振動ポテンシャルは低いエネルギー(小さい量子数)の準位においてはよい近似ではある。しかし、実際の分子のポテンシャルは、原子間距離が小さくなる方向には原子間の排斥力により2乗の関数よりもさらに急激に上昇し、原子間距離が大きくなる方向では、緩やかであり、無限遠の極限においてはお互いに力を及ぼしあわなくなる。
以上のような違いから、実際の振動準位は、量子数が増えるにつれて準位間隔が狭くなっていき、遠距離の極限以上のエネルギー以上では量子化されない連続なエネルギー帯となっている。また、実際には振動量子数の変位 となる遷移も起こりうる。
これらの性質を非調和性と呼ぶ。
調和振動子よりも実際の分子のポテンシャルをモデル的に表すポテンシャルとしては、モースポテンシャルがよく知られる。
二原子以上の分子の振動準位[編集]
振動の自由度[編集]
N個の原子からなる分子の原子核の運動は、たとえばそれぞれの原子が3次元直交座標上で運動することを考えれば、3N個の運動の自由度を持つことがわかる。その中に、3つはそれぞれの座標方向に運動する並進運動、さらに核間距離を変えずにそれぞれの座標軸を中心として運動する3つの回転運動(直線分子では2つ)が含まれる。残りの 3N−6個(直線分子では3N−5個)が振動運動の自由度となる。
基準座標(基準振動)[編集]
基準座標とは、一般的な振動を表現するときに、振動のエネルギー固有値を与える変位の座標である。この基準座標は一般的な原子核の運動の座標(平衡位置からの変位の座標)を一次変換することにより得られる。たとえば、水分子 H2O(振動の自由度は 3×3−6 = 3個)の基準座標は、二つの O-H の核間距離がともに伸びたり縮んだりする対称伸縮振動(v1)、H-O-Hのなす角が変わる変角振動(v2)、二つの O-H の核間距離が一方は伸び一方は縮むという非対称伸縮振動(v3)の3つがある。
基準座標を求める方法としては、分子内部座標から基準座標を求める GF行列法などが知られている。
グループ振動[編集]
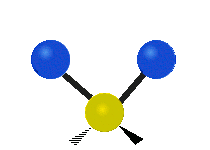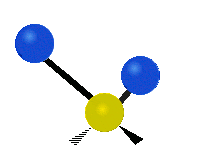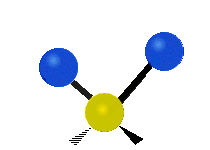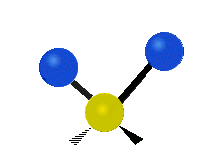
このように分子に対して、3N-6 (直線分子では3N-5)個の振動座標を求めると、分子の中に-X-H(X=C, O, Nなど)のように軽い原子を含む部分や、多重結合(C=O, C=C など)のように強い結合(力の定数の大きな結合)があると、そのグループ(原子団)特有の振動座標が現れる。原子数の大きな分子になると基準振動座標がこれらのグループに局在することから、このようなグループ特有の振動をグループ振動と呼ぶ。例えば、分子内のメチレン基(CH2)特有の振動として以下の表に示すような振動座標が知られている。
| 対称伸縮 | 非対称伸縮 | 対称面内変角 はさみ (Scissoring,Bending) |
|---|---|---|
|
|

|
| 逆対称面内変角 横揺れ(Rocking) |
対称面外変角 縦揺れ(Wagging) |
逆対称面外変角 ひねり(Twisting) |

|

|

|
N原子分子[編集]
N個の原子からなる多原子分子では3N-6(直線分子では3N-5)個の基準振動が存在する。これらの基準振動の振動数を、、・・・、対応する振動量子数を、、・・・とすると、分子の振動準位のエネルギーは
で表される。ここでは非調和定数である。これらの準位間の遷移によって振動スペクトルが生じる。この場合、基準振動によって双極子モーメントが変化すれば赤外スペクトルとして、また分極率が変化すればラマンスペクトルとして観測される。
関連項目[編集]
























