ポリグリコール酸
| ポリグリコール酸 | |
|---|---|
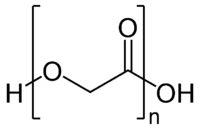
| |
poly(ethanoate) | |
| 識別情報 | |
| CAS登録番号 | 26124-68-5 |
| |
| 特性 | |
| 化学式 | (C2H2O2)n |
| モル質量 | (58.04)n |
| 密度 | 1.530 g/cm³ at 25 °C |
| 融点 |
225-230 °C |
| 沸点 |
分解 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ポリグリコール酸(ポリグリコール酸、Polyglycolic acid、略号:PGA)ないしはポリグリコライド(Polyglycolide)は生分解性熱可塑プラスチックの一種であり、もっとも単純な鎖状脂肪族のポリエステルでもある。ポリグリコール酸(PGA)はグリコール酸を出発物質とし、縮合重合または開環重合により生成する。PGAは強靭な繊維となる重合体であることが1954年には知られていた。加水分解する性質のため、重合体は不安定であり初期においては用途は限られたものであった。[1] 現在ではポリグリコール酸ないしはグリコール酸コポリマー、たとえば乳酸とのコポリマー(乳酸-グリコール酸コポリマー)、カプロラクトンとのコポリマー(グリコール酸-カプロラクトンコポリマー)、炭酸トリメチレンとのコポリマー(グリコール酸-炭酸トリメチレンコポリマー)など各種機器の素材や外科の合成吸収性縫合糸への利用され、バイオメディカルエンジニアリング用素材として評価されつつある。 [2] 最近、溶融温度以上での熱安定性を改良する事で一般的なプラスチックの成形技術でも加工できるようになり、新規な用途開発が進んできている。
物理特性[編集]
PGAのガラス転移点は35—40℃であり、融点は220—230℃であると報告されている。PGAは60℃以上で結晶化により透明さを失う[1]。ポリエステルの溶解性は特徴があり、分子量(平均分子量)が大きくなると大抵の有機溶媒(アセトン、ジクロロメタン、クロロホルム、酢酸エチル、テトラヒドロフランなど)には解けなくなる。低分子であるオリゴマーではまったく物性は異なりDMSOなどの有機溶媒に可溶である。一方、PGAは高分子でもヘキサフルオロ2-プロパノール(HFIP)やペルフルオロアセトンの様なフッ素系の溶媒には溶解するので、高分子ポリマーの溶液にして溶融紡糸したりフィルム状にすることができる。[3] PGA繊維は強靭性を示し、ヤング率は(7 GPa)で、剛直である[2]。そのため、吸収性縫合糸に用いられる際は、細い糸を束ねたマルチフィラメントで使われている。
合成法[編集]
PGAの合成法は出発物質の違いにより、いくつかの異なる合成法がある。
グリコール酸の縮合重合はPGAを合成するのにもっとも単純な方法であるが、低分子のオリゴマーが生成物となり効果的ではない。以下に手短に反応を説明する。 グリコール酸を常圧で175—185℃ほどに加熱し、発生する水を留去する。その後150 mmHgに減圧し、その温度で2時間保つと低分子のPGAが得られる[4]。
高分子ポリマーが得られる代表的な方法は、グリコール酸の環状ジエステルであるグリコリドの、開環重合である。当のグリコリドは低分子PGAを減圧で加熱するとジエステル体(グリコリド)は留出するので、これを捕集する。グリコリドの開環重合にはさまざまな触媒があり、アンチモン化合物系触媒には三酸化アンチモンやアンチモントリハライドがあり、亜鉛化合物系触媒として乳酸亜鉛、スズ化合物系触媒として2-エチルヘキサン酸スズ(II)やスズアルコキシドがある。中でもFDAが食品安定化剤として認可している2-エチルヘキサン酸スズ(II)が重合開始剤として広く使用されている。特許開示されている他の触媒としてはアルミニウムイソプロポキシドやカルシウムアセチルアセトナートやいくつかのランタノイドアルコキシド(例、イットリウムイソプロポキシド)があげられる[4][5][6]。手短に開環重合反応の概略を示す。 触媒量の重合開始剤を、窒素雰囲気下に195℃でグリコリドに加える。重合反応は二時間ほどで進行し、次いで温度を230℃に上昇させ、30分ほど保持する。固化させると高分子ポリマーが得られる[4]。

次の方法は、一般式X-—CH2COO-M+(Mはナトリウムのような一価の金属、Xは塩素の様なハロゲン)であらわされるハロゲノ酢酸塩を固相触媒で熱時縮合反応させる方法である。反応の結果PGAと塩の結晶とが生成する。すなわちクロロ酢酸ナトリウムの様なハロ酢酸塩を160—180℃で持続的に反応容器に窒素を吹き込むと反応は進行する。反応により生成したPGAと晶出した塩化ナトリウムを取り込んだポリマーマトリックスが得られる。塩は反応生成物を水洗することで簡単に除去される[7]。
PGAは酸触媒存在下に一酸化炭素とホルムアルデヒド(あるいはその等価体であるパラホルムアルデヒドやトリオキサン)との反応によっても得られる。オートクレーブに触媒(クロロ硫酸とジクロロメタン)とトリオキサンを封入し、ある圧力まで一酸化炭素を導入する。反応液を攪拌し、温度は約180℃以下に2時間保つ。反応が完了したら、容器内の一酸化炭素を取り除くと高分子PGAが得られる[8]。
分解[編集]
PGAは骨格中にエステル結合を持ち、それ故に加水分解反応しやすい特性を有している。加水分解は侵食の態を示し2段階でポリマーはモノマーであるグリコール酸に変換される。最初はポリマーマトリックスのアモルファス(非晶)領域に拡散し、エステル骨格を開裂させる。二段階目はアモルファス領域が侵食された後に開始する。結晶部分で弱いところから加水分解の攻撃を受ける。そしてポリマー鎖が解け、結晶領域も崩壊する。
生理条件下にさらされた場合、PGAはランダムな加水分解により分解し、それは恐らくはある種の酵素、特にエステラーゼの作用によっても破壊される。分解生成物のグリコール酸には毒性は無く、クエン酸回路によって代謝され、最終的には水と二酸化炭素とになる。あるいは一部のグリコール酸は尿中に排泄される[9]。
PGA製吸収性縫合糸の研究によると、素材の強度は2週間で半減し、4週間でほぼ100%失われる。糸が完全に生体に取り込まれるには、4ないしは6ヶ月の期間である[2]。
用途[編集]
1954年からPGAは知られているが、当初は他の合成ポリマーに比べて分解しやすかったのでごく少数の用途しか見いだせなかった。しかし1962年にアメリカンシアナミド社の子会社のDavis & Geck社からDexonという商標で最初の合成吸収性縫合糸の市場が開発された[1] 。 PGAは強靭な繊維であり、モノマーは水溶性のため、このポリマーで作った縫合糸は、抜糸のための医療処置か不要になる外科手術に応用された。また留置型(埋込み型)医療機器にPGAは広く使用され、吻合リング、ピン、棒、プレートあるいは螺子などに適用されている[2]。
伝統的なPGAの用途は生分解性の縫合・接合素材であるが、医療生体工学の別分野、すなわち再生医療やドラッグデリバリーシステムなどにも展開している。紡績技術の不織布を応用した別のアプローチでPGA製の再生医療用の部品が開発されている。
外科領域ではPGA縫合糸は標準仕様となっている。
2011年、クレハ及びKureha PGAは、アメリカ合衆国ウェストバージニア州で工業プラントを稼働させた。高いガスバリア性ポリエステルとしてPET樹脂と多層化することでPETボトルのガスバリア性能を大幅に向上させる事ができるため、小型ボトルでの炭酸ガスロスによる商品寿命低下の抑制や、PET使用量を減らす事で軽量化等が期待される。またUSを中心としたシェールガス・オイルの掘削部材としての採用が本格化してきており、これまでの限定された医療分野から用途分野が大きく拡大していく可能性を秘めている。 [10]
註・出典[編集]
- ^ a b c Gilding, D. K.; A. M. Reed (December 1979). “Biodegradable polymers for use in surgery - polyglycolic/poly (lactic acid) homo- and copolymers: 1”. Polymer 20: 1459–1464. doi:10.1016/0032-3861(79)90009-0.
- ^ a b c d Middleton, J.; A. Tipton (March 1998). “Synthetic biodegradable polymers as medical devices” (HTML). Medical Plastics and Biomaterials Magazine 2006年7月4日閲覧。.
- ^ Schmitt, E.: "Polyglycolic acid in solutions", U.S. Pat3,737,440, 1973
- ^ a b c Lowe, C. E.: "Preparation of high molecular weight polyhydroxyacetic ester", U.S. Pat2,668,162, 1954
- ^ Bero, Maciej; Piotr Dobrzynski, Janusz Kasperczyk (18 June 1999). “Application of Calcium Acetylacetonate to the Polymerization of Glycolide and Copolymerization of Glycolide with ε-Caprolactone and L-Lactide”. Macromolecules (ACS) 32 (14): 4735–4737. doi:10.1021/ma981969z.
- ^ Stridsberg, Kajsa M.; Maria Ryner, Ann-Christine Albertsson (2002). “Controlled Ring-Opening Polymerization: Polymers with designed Macromolecular Architecture”. Advances in Polymer Science (Springer) 157: 41–65. doi:10.1007/3-540-45734-8_2. ISSN 0065-3195.
- ^ Epple, Matthias (1999). “A detailed characterization of polyglycolide prepared by solid-state polycondensation reaction”. Macromolecular Chemistry and Physics (Wiley) 200 (10): 2221–2229. doi:10.1002/(SICI)1521-3935(19991001)200:10<2221::AID-MACP2221>3.0.CO;2-Q.
- ^ Masuda et al.: "Biodegradable plastic composition", U.S. Pat5,227,415, 1993
- ^ Gunatillake, Pathiraja A.; Raju Adhikari (2003). “Biodegradable Synthetic Polymers for tissue engineering” (PDF). European Cells and Materials 5: 1–16. ISSN 1473-2262 2006年7月4日閲覧。.
- ^ "Yamane,K., Sato,H., Ichikawa,Y., Sunagawa,Y. and Shigaki,Y., Development of an industrial production technology for high-molecular-weight polyglycolic acid, Polymer Journal (2014) 46, 769–775; doi:10.1038/pj.2014.69; published online 6 August 2014"http://www.nature.com/pj/journal/v46/n11/abs/pj201469a.html
