ジチオトレイトール
| ジチオトレイトール | |
|---|---|
 還元型
| |
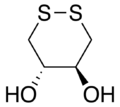 酸化型
| |
(2S,3S)-1,4-Bis-sulfanylbutane-2,3-diol | |
別称 Threo-1,4-dimercaptobutane-2,3-diol DL-Threo-1,4-dimercapto-2,3-butanediol 1,4-Dithio-DL-threitol ±-Threo-1,4-dimercapto-2,3-butanediol Cleland's reagent Reductacryl | |
| 識別情報 | |
| CAS登録番号 | 3483-12-3, 16096-98-3 (酸化型) |
| KEGG | C00265 C01119 (酸化型) |
| |
| 特性 | |
| 分子式 | C4H10O2S2 |
| 外観 | 白色結晶 |
| 融点 |
42-43 ℃ |
| 沸点 |
125-130 ℃ (2 mmHg) |
| 水への溶解度 | 溶ける |
| 関連する物質 | |
| 関連する異性体 | ジチオエリトリトール |
| 出典 | |
| Merck Index, 11th Edition, 3382. | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ジチオトレイトール (dithiothreitol, DTT) またはジチオスレイトールは低分子酸化還元剤のひとつ。分子式は C4H10O2S2 であり、還元型では直鎖状、酸化型ではジスルフィド結合によって6員環となる。この名称は四炭糖のトレオースに由来している。ジチオエリトリトール (DTE) とはエピマー(異性体)の関係にある。クリーランド試薬 (Cleland's reagent)・クレラン試薬とも呼ぶ。SDSポリアクリルアミドの電気泳動で用いられる。
還元剤[編集]
DTTは分子内ジスルフィド結合による6員環を形成する傾向が強いことから、非常に強い還元剤である。酸化還元電位はpH 7で-0.33Vである。典型的なジスルフィド結合は、下図のような連続したチオール/ジスルフィド交換反応により還元される。2つめのチオール基は環を閉じようとする傾向が強いため中間体は不安定で、酸化型DTTが生じてジスルフィド結合が還元される。チオール基のpKaは通常8.3程度であり、負に帯電したチオレート型の -S- だけが反応性を持っているため、DTTの還元力はpHが7以上の場合に限られる。

利用[編集]
DTTの利用法として良くあるのはチオール化したDNAを還元して「脱保護」するものである。チオール化DNAの末端の硫黄原子は(特に酸素存在下の)溶液中で二量体を作りやすい。例えばバイオセンサーとして金表面にDNAを固定化するような場合、二量体が形成されるとカップリング反応の効率が著しく低下する。そこでDNA溶液にDTTを加えて反応を助け、その後濾過やクロマトグラフィーによってDTTを除去(「脱塩」)する。
DTTはタンパク質のジスルフィド結合を還元し、タンパク質のシステイン残基の間で分子内または分子間のジスルフィド結合が形成されないようにするためによく使われる。しかしDTTは埋没した(溶液にさらされていない)ジスルフィド結合を還元することはできないので、ジスルフィド結合の還元は高温または高濃度の変性剤(6M塩酸グアニジン、8M尿素、1% SDSなど)を加えた変性条件で行うことが多い。逆に、個々のジスルフィド結合が溶液にさらされているかどうかをDTTによる還元速度で分析することもできる。
DTTは酸化剤として用いることもできる。グルタチオンなど他の薬剤とは違い、ジスルフィド種が混合しないという利点がある。非常に稀なことだが、DTTの2つの硫黄原子が異なる硫黄原子とジスルフィド結合をつくりDTT付加物が生成することがある。その場合は、自由なチオール基がないためDTTは環状化できない。
性質[編集]
空気酸化を受けやすいためDTTは比較的不安定な化合物であるが、冷凍して不活性気体雰囲気下で取り扱うことにより寿命を長くすることができる。プロトン化した硫黄原子は求核性が低いため、pHが低下するとDTTの作用が落ちる。より安定で低pHでも作用する代替品 Tris(2-carboxyethyl)phosphine塩酸塩(TCEP HCl) がある。
参考文献[編集]
- Cleland WW. (1964) "Dithiothreitol, A New Protective Reagent for SH Groups", Biochemistry, 3, 480-482.
- Ruegg UT and Rudinger J. (1977) "Cleavage of disulfide bonds in proteins", Methods Enzymol., 47, 111.
