ウラニルイオン


ウラニルイオン (英: uranyl ion) は、化学式が UO22+ と表されるウランのオキシカチオンで、ウランの酸化数は+6である。ウランと酸素の間に多重結合性があることを示す短い U-O 結合をもち、直線形構造をとる。4つまたはそれ以上のエカトリアル配位子がウラニルイオンに結合する。特に酸素ドナー原子をもつ配位子と多くの錯体を形成する。ウラニルイオンの錯体は、鉱石からのウランの抽出、そして核燃料再処理において重要である。
構造と結合[編集]

ウラニルイオンは直線形の対称的な構造で、U-O 結合長はそれぞれ約180 pmである。この短い結合長はウラン原子と酸素原子の間に多重結合性があることを示している。ウラン(VI)はラドンと同じ電子配置をもつため、U-O 結合を形成するために使われる電子は酸素原子から供給される。電子はウラン原子の空の原子軌道に供与される。最もエネルギーの低い空軌道は7s、5f、6d軌道である。原子価結合法において、σ結合は 軌道と 軌道を使ってつくられるsd、sf、df混成軌道によって形成されると考えられる。結合に使われたd軌道またはf軌道は二重縮重しているため、U-O 結合次数は全体として3である[1]。
ウラニルイオンは常に他の配位子と結合している。最もよく見られるのは、O-U-O 結合と直交する平面に存在する配位子、いわゆるエカトリアル配位子がウラン原子を通して結合する配置である。配位子4つでは、UO2Cl42- のように歪んだ八面体形構造をとっている。多くの場合は4つ以上のエカトリアル配位子を伴う。エカトリアル配位子の存在は、ウラニルイオンの対称性を直線形の孤立イオンの点群 D∞h から、例えば歪んだ八面体の点群 D4h にまで下げる。これは、U-O 結合においてウランと酸素が使っていないd軌道やf軌道の関与を認める。
フッ化ウラニル UO2F2 において、ウラン原子はウラニルイオンの2つの酸素原子と、ウラニル間を架橋する6つのフッ化物イオンとで層状構造を形成することによって、配位数8となっている。層間が共有酸素原子で結ばれていることを除いて、類似した構造がフッ化ウラニルのフッ化物イオンを酸素で置換したα-三酸化ウランで見られる。これは比較的短い U-O 結合をもっていることによって判断される。また、構造中に孤立したウラニルイオンを含まないが、ウラン酸カルシウムの CaO4 単位でも同様の構造が見られる。このことから、ウラン酸カルシウムは Ca(UO2)O2 と表されることもある[2]。
分光法[編集]
ウラニル化合物の色は、可視光スペクトルの青色端420 nm付近の LMCT 電荷移動遷移に起因している[3][4]。吸収バンドと NEXAFS バンドの正確な位置は、エカトリアル配位子の性質に依存する[5]。ウラニルイオンを含む化合物は通常黄色であるが、いくつかの化合物は赤色、緑色、またはオレンジ色である。
ウラニル化合物は蛍光を発する。ウランガラスの緑色蛍光の最初の研究は、1849年のディヴィッド・ブリュースター[6]によるウラニルイオンの分光学における広範な研究に端を発する。このスペクトルについての詳細な理解は130年後に得られた[7]。K2UO2(SO4)2 からの蛍光は放射能の発見に寄与した。
ウラニルイオンは、880 cm−1(ラマンスペクトル)と950 cm−1(赤外吸収スペクトル)の位置で特有の v U-O 伸縮振動をもっている。これらの波数は、いくらかエカトリアル配位子の種類によって異なる。伸縮振動数と U-O 結合長の間には相関が見られる。また、分光化学系列におけるエカトリアル配位子の位置にも相関することが発見された[8]。
水溶液の化学[編集]

ウラニルイオンは、高度に帯電した仮想的な U6+ イオンの加水分解による最終生成物とみなすことができる。
この仮想的な反応の推進力は、ウラン原子上の電荷密度の減少による。水溶液中ではウラニルイオンと結合している水分子の数は4である[9]。1つ以上のエカトリアル位の水分子が水酸化物イオンになるとき、電荷密度がさらに減少することによって加水分解が促進される。実際、ウラニルイオンのアクア錯体は弱酸である。
pH が増加すると、水酸化ウラニル UO2(OH)2 が沈殿する前に、化学量論のポリマー種 と が形成される。水酸化ウラニルは強塩基性溶液に溶け、ウラニルイオンのヒドロキシド錯体を与える。
ウラニルイオンは、金属亜鉛のような穏やかな還元剤によって酸化数+4まで還元することができる。ジョーンズ還元器を用いることでウラン(III)に還元可能である。
錯体[編集]

ウラニルイオンは硬いアクセプターとして振る舞い、水酸化物イオン、炭酸イオン、硝酸イオン、硫酸イオン、カルボン酸イオンのような酸化物イオンまたはフッ化物イオンドナー配位子より、窒素ドナー配位子と弱い錯体を形成する。エカトリアル位には4〜6つのドナー原子が存在する。例えば硝酸ウラニル [UO2(NO3)2]•2H2O では、エカトリアル平面内に二座ニトラト配位子からの4つと水分子からの2つ、合計6つのドナー原子がある。この構造は六角両錐であると表される。他の酸素ドナー原子にはホスフィンオキシドやリン酸エステルがある[11]。
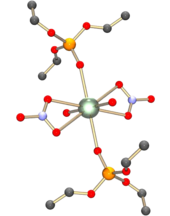
硝酸ウラニルは水溶液からジエチルエーテル中に抽出することができる。抽出された錯体は電荷をもたず、ウラニルイオンと結合した2つのニトラト配位子をもっている。水分子はエーテル配位子と置換され、錯体全体に顕著な疎水性を与える。電気的中性であることは、錯体を有機溶媒に溶かすための最も重要な要因である。硝酸イオンは、遷移金属イオンやランタノイドイオンよりもずっと強固なウラニル錯体を形成する。このため、ウラニルイオンとプルトニルイオン PuO22+ のような他のアクチニルイオンのみを他のイオンを含む混合物から抽出することができる。水溶液中でウラニルイオンと結合している水分子を代わりの疎水性配位子で置換することは、電気的中性な錯体の有機溶媒に対する可溶性を増加させる。これはシナジー作用と呼ばれる[12]。
水溶液中のウラニルイオン錯体は、鉱石からのウランの抽出においても、そして核燃料の再処理においてもともに重要である。工業的には硝酸ウラニルの抽出は、好ましい代替配位子にリン酸トリブチル (TBP)、有機溶媒にケロシンを用いて行われる。このプロセスの後、これを硝酸で処理することによって有機溶媒から分離される。ウランは水相においてより溶解度の高い [UO2(NO3)4]2- のような錯体を形成する。この溶液を蒸発させることによって硝酸ウラニルが再生される[11]。
鉱物[編集]
ウラニルイオンは、ウランに富んだ鉱物の割れ目で起こる水-岩石相互作用により生じる鉱脈から産出する。ツヤムン石 (Ca(UO2)2V2O8•8H2O)、燐灰ウラン石 (Ca(UO2)2(PO4)2•8-12H2O)、燐銅ウラン石 (Cu(UO2)2 (PO4)•8-12H2O)、ウラノフェン石 (H3O)2Ca (UO2)2(SiO4)•3H2O) などがウラニルイオンを含む鉱物の例である。大半のウランはピッチブレンドから抽出されるため、これらの鉱物はほとんど商業価値を有さない。
利用[編集]
ウラニル塩は、DNA の電子顕微鏡による研究でサンプルを染色するために用いられる[13]。
健康と環境問題[編集]
ウラニル塩は有毒で、重篤な腎不全や急性尿細管壊死を起こすことがある。腎臓、肝臓、肺、脳に損傷を与える[14]。始原生殖細胞[15]を含む組織におけるウラニルイオンの蓄積は先天性疾患を引き起こし、白血球に免疫機能障害を起こす。ウラニル塩は神経毒でもある。ウラニルイオンによる汚染は劣化ウランの目標とその周辺で見られた[16]。
すべてのウラン化合物は放射性である。しかし原子力産業では、ウランは通常劣化ウランの形をとる。劣化ウランは主に4.468(3) × 109 年の半減期でα崩壊する 238U からなる。これは弱いα線源であるため、この放射能は直接接触するか、もしくは摂取した場合のみ有害である。
出典[編集]
- ^ Cotton, S (1991), Lanthanides and Actinides, New York: Oxford University Press, p. 128
- ^ Wells, A.F (1962), Structural Inorganic Chemistry (第3 ed.), Oxford: Clarendon Press, p. 966, ISBN 0198551258
- ^ Umreiko, D.S. (1965), “Symmetry in the electronic absorption spectra of uranyl compounds”, J. Appl. Spectrosc. 2 (5): 302–304, doi:10.1007/BF00656800
- ^ Berto, Silvia (2006), “Dioxouranium(VI)-Carboxylate Complexes. Interaction with dicarboxylic acids in Aqueous Solution: Speciation and Structure”, Annali di Chimica 96 (7-8): 399-420, doi:10.1002/adic.200690042
- ^ Fillaux, C.; Guillaumont, D.; Berthet, J-C; Copping, R.; Shuh, D.K.; Tyliszczak, T.; Den Auwer, C. (2010), “Investigating the electronic structure and bonding in uranyl compounds by combining NEXAFS spectroscopy and quantum chemistry”, Phys. Chem. Chem. Phys. 12 (42): 14253–14262, doi:10.1039/C0CP00386G, PMID 20886130
- ^ Brewster, D. (1849), Trans. R. Soc. Edinburgh 16: 111–121
- ^ Denning, R. G. (2007), “Electronic Structure and Bonding in Actinyl Ions and their Analogs”, J. Phys. Chem. A 111 (20): 4125–4143, doi:10.1021/jp071061n, PMID 17461564
- ^ Nakamoto, K. (1997), Infrared and Raman spectra of Inorganic and Coordination compounds, Part A (第5 ed.), Wiley, ISBN 0471 16394 5, Part B, ISBN 0471 16392 9 Part A, p 167. Part B, p 168
- ^ Burgess, J. Metal ions in solution, (1978) Ellis Horwood, New York. p153
- ^ IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ a b グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. pp. 1273–1274. ISBN 978-0-08-037941-8。
- ^ Irving, H.M.N.H. (1965), “Synergic Effects in Solvent Extraction”, Angewandte Chemie International Edition 4 (1): 95–96, doi:10.1002/anie.196500951
- ^ Zobel, R. and Beer, M. (1961) "ELECTRON STAINS : I. Chemical Studies on the Interaction of DNA with Uranyl Salts" J. Biophys. and Biochem. Cytol., vol. 10, pp. 335-346
- ^ Schröder H, Heimers A, Frentzel-Beyme R, Schott A, Hoffman W (2003), “Chromosome Aberration Analysis in Peripheral Lymphocytes of Gulf War and Balkans War Veterans”, Radiation Protection Dosimetry 103 (3): 211–219, PMID 12678382
- ^ Arfsten DP, Still KR, Ritchie GD (2001), “A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development”, Toxicology and Industrial Health 17 (5-10): 180–191, doi:10.1191/0748233701th111oa, PMID 12539863
- ^ Salbu B, Janssens K, Linda OC, Proost K, Gijsels L, Danesic PR (2004), “Oxidation states of uranium in depleted uranium particles from Kuwait”, Journal of Environmental Radioactivity 78 (2): 125–135, doi:10.1016/j.jenvrad.2004.04.001, PMID 15511555



![{\displaystyle {\ce {[U(H2O){\mathit {n}}]^{6+}->\ [UO2(H2O)4]^{2+}\ +4H^{+}\ +{\mathit {n}}-4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba1cb7f1c158d9513700357003169bb2a85ac7c9)
![{\displaystyle {\ce {[UO2(H2O)4]^{2+}<=> \ [UO2(H2O)3(OH)]^+\ + H^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b5e4f7876a20b5dcd4a081bed84aadd60a76f50)
![{\displaystyle {\ce {[(UO2)2(OH)2]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19e04da0b15d39ed724363a0dfc649f754ee68e0)
![{\displaystyle {\ce {[(UO2)3(OH)5]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebff81ef376c94df8d8bec774d0476c8817dee6d)